양극의 전기화학적 활성 P2-Nax[Mg0.33Mn0.67]O2 나트륨 이온 배터리 소재
저자: ZHANG Xiaojun1, LI Jiale1,2, QIU Wujie2,3, YANG Miaosen1, 리우 지안쥔2,3,4
1. 길림성 바이오매스 청정전환 및 고부가가치 활용 과학기술센터, 동북전력대학, 길림 132012, 중국
2. 고성능 세라믹 및 초미세 미세 구조 국가 핵심 연구소, 상하이 세라믹 연구소, 중국 과학 아카데미, 상하이 200050, 중국
3. 중국과학원대학교 재료과학 및 광전자 공학 센터, 베이징 100049, 중국
4. 중국과학원 항저우고등연구소 화학재료과학부, 항저우 310024, 중국
초록
원재료의 저렴한 가격과 폭넓은 유통의 장점을 바탕으로 나트륨이온전지는 최고의 대체 소재로 꼽힌다. 리튬이온 배터리 양극재. 층층이 있는 P2상 NaMnO2에서 구조, 전이 금속 층의 이원 고용체는 효과적으로 할 수 있습니다 전극 재료의 전기화학적 성능을 향상시킵니다. 이에 Mg 이온이 포함된 Nax[Mg0.33Mn0.67]O2의 구조 모델 연구 쿨롱 모델을 사용하여 고용체를 구성했습니다. 그만큼 첫 번째 원리 계산에 따르면 Nax[Mg0.33Mn0.67]O2의 방전 전압은 한 번에 3.0V에 도달했습니다. 0.67 미만의 나트륨 이온 함량. 상태 및 전하의 전자 밀도 인구 분석에 따르면 Mg의 고용체가 음이온을 유발하는 것으로 나타났습니다. P2상 Nax[Mg0.33Mn0.67]O2 내 격자 산소의 전기화학적 활성 양이온과 음이온의 시스템의 전기화학 반응 메커니즘 가역적 음이온 산화환원 반응에 대한 시너지 산화환원 반응. 이것 변환은 전극 재료 설계를 위한 새로운 방법을 제공합니다 Na 이온 배터리의 최적화 및 기타 이온전지 탐색
키워드ï¼ 나트륨 이온 배터리; 전기화학 활동 ; 첫 번째 원칙; 알칼리금속 도핑
TOB NEW ENERGY는 배터리 소재, 배터리 기계, 배터리 생산 라인 솔루션과 전고체 배터리용 배터리 기술 풀세트를 제공합니다. 나트륨이온전지, 리튬이온전지 제조
Berthelot et al.[10]은 다음을 발견했습니다. 단일 전이 금속(TM), 나트륨을 포함하는 층상 산화물 NaTMO2에서 이온과 공극은 순수한 나트륨 층에 정렬되어 많은 결과를 낳습니다. 방전 과정에서 이러한 유형의 산화물을 위한 전압 플랫폼입니다. . 이것 특정 용량의 급속한 감소와 상당한 감소를 초래합니다. 사이클 성능이므로 이러한 유형의 산화물의 에너지 변환 효율은 낮은. 고용원소가 전이금속층에 도입되어 이원소 또는 다중 원소 전이 금속의 혼합 배열을 형성합니다. 그만큼 전극 재료에는 많은 수의 무질서한 전하가 포함되어 있습니다. 위의 전압 플랫폼을 효과적으로 억제하고 에너지 변환을 향상시킵니다. 능률. Yabuuchi 등[11]은 Na2CO3, (MgCO3)4Mg(OH)2·5H2O를 사용했습니다. 및 MnCO3를 원료로 합니다. 900°C에서 고체 반응이 수행되었습니다. 이원 무질서한 P2 상 Na2/3[Mg1/3Mn2/3]O2 전극을 얻는 데 12시간 Mg 고용체를 갖는 재료. 그들은 전류밀도 10에서 mA/g, 준비된 P2 상의 초기 비용량 Na2/3[Mg1/3Mn2/3]O2 양극재는 약 150mAh/g이었습니다[11]. 약간 Na2/3MnO2(184mAh/g)의 비용량보다 낮습니다. Bruce 등은[12] 격자의 전기화학적 반응이 있음을 발견했습니다. P2 상 Na2/3[Mg1/3Mn2/3]O2의 산소, 산소 침전 없음 관찰됨. Mg의 도입으로 사이클 가역성이 향상됨을 보여줍니다. 그리고 재료의 가역적 특정 용량. 그러나 충전 중에는 및 방전 과정, 미세한 전기 화학 반응 메커니즘 이 시스템의 격자 산소는 아직 명확하지 않으며, 그 메커니즘은 Mg 고용체가 시스템의 안정성을 향상시키는지도 불분명하다.
따라서 이 작업은 P2 단계를 거친다. Nax[Mg0.33Mn0.67]O2를 연구 대상으로 삼고 제1원리를 채택 밀도 함수 이론(DFT)의 계산 방법. 에 대한 체계적인 연구 방전의 전기화학적 활동과 구조적 안정성 Mg 고용체를 이용한 Nax[Mg0.33Mn0.67]O2 양극재의 성능 이온을 실시했습니다. 전극의 미세한 메커니즘을 규명하기 위해 마이크로 규모의 전자에서 전기화학 반응에 사용되는 물질과 원자, 전기화학의 이해에 참고자료가 될 것이다. 프로세스 및 신소재 디자인.
1 계산방법
이 작업의 계산은 다음을 기반으로 합니다. 밀도의 평면파 기반 소프트웨어 VASP 패키지[13,14] 기능 이론. 가산 평면파 방법이 사용되며[15], 교환 상관 함수는 일반화된 기울기 근사입니다. (GGA)는 Perdew-Burker-Ernzerhof[13,16] 형태입니다. 허바드 매개변수 U는 Mn의 d 전자를 수정하기 위해 도입되었으며 유효 U는 값은 3.9eV[17,18]입니다. 하부 평면파의 차단 에너지 600eV입니다. 이온 이완이 완료되면 모든 원자에 가해지는 힘이 작아집니다. 0.1eV·nm-1보다. 결정 구조를 최적화할 때 3ø3ø1(원자 72개) 슈퍼셀 구조가 사용되며, 격자 상수는 0.874 nm × 0.874 nm × 1.056입니다. nm이고 Brillouin 구역의 k-포인트 그리드는 3×3×3[19]입니다. 그만큼 동결 포논 방법을 사용하여 격자 진동 스펙트럼을 계산했습니다. Phonopy 소프트웨어 패키지. 주기적인 영향을 피하기 위해 경계 조건에서 3×3×1 슈퍼셀 구조를 사용하여 계산했습니다. P2 상 NaMnO2 및 Na[Mg0.33Mn0.67]O2의 힘 상수 및 포논 스펙트럼. 점전하 쿨롱 모델은 이온 점유를 빠르게 계산하는 데 사용됩니다. 탈 나트륨 구조 및 Na 직업 구성이 가장 낮습니다. 보다 정확한 제1원리 계산을 위해 쿨롱 에너지가 선택되었습니다[20]. 전극재료의 방전전압은 다음과 같이 표현된다.[20]:
$V=-\frac{G(\text{N}{{\text{a}}_{{{x}_{2}}}}\text{M}{{\text{O} }_{2}})-G(\text{N}{{\text{a}}_{{{x}_ {1}}}}\text{M}{{\text{O}}_{2}})-({{x}_{2}}-{{x}_{1}})G(\ 텍스트{Na})}{({{x}_{2}}-{{x}_{1}}){{e}^{-}}}$
여기서 G는 총 에너지이다. 해당 시스템이고, e-는 원소전하[21]이다.
2 결과 및 논의
2.1 미세구조적 특성 및 구조적 안정성
P2 상 NaMnO2의 공간군 구조는 R$\bar{3}m입니다(그림 1)[22,23]. 공간 구성 Mg 고용체 Na0.67[Mg0.33Mn0.67]O2 구조는 NaMnO2. Mg 이온은 전이금속층의 Mn 이온의 1/3을 대체합니다. 그만큼 Mg 대 Mn의 이론적 이온 비율은 1:2입니다. 실험적 특성 발견 이 비율에서는 Nax[Mg0.33Mn0.67]O2 구조의 Mg 이온만 형성됩니다. Mn과의 무질서한 배열은 Na 층의 순서를 유지합니다. 이온 비율 Mg:Mn1:2인 경우 Mg, Na 및 Mn은 무질서한 구조를 형성합니다. 양이온의 배열. 그림 1(A)와 같이 격자의 적층 모드는 산소는 ABBA..., Mg 및 Mn은 각각 사이의 팔면체 사이트를 차지합니다. 산소 AB 층과 Na는 AB 층 사이의 삼각 프리즘 사이트를 차지합니다. 산소 AA 및 BB 층[25,26]. 그림 1(B)에 나타난 바와 같이, 전이금속층에 Mg와 Mn이 벌집모양으로 배열되어 있는 것[27], 이는 리튬이 풍부한 화합물에서 Li와 Mn 사이의 배열과 유사합니다[28]. [MgO6] 팔면체는 6개의 [MnO6] 팔면체가 공유되어 배열되어 있습니다. 가장자리[29,30]. 알칼리 금속층에는 Na0.67[Mg0.33Mn0.67]O2 구조에는 나트륨 이온에 대한 두 개의 격자 위치가 있습니다. 하나는 [MgO6] 또는 [MnO6] 팔면체의 상하층이 배열되어 있습니다. 가장자리를 공유합니다. 다른 하나는 상층과 하층이 동일 평면상에 배열되어 있습니다. [MgO6] 또는 [MnO6] 팔면체
![Fig. 1 Schematic diagram of P2-Na2/3[Mg1/3Mn2/3]O2 Fig. 1 Schematic diagram of P2-Na2/3[Mg1/3Mn2/3]O2](/js/htmledit/kindeditor/attached/20231108/20231108103040_37156.webp)
그림. 1 P2-Na2/3[Mg1/3Mn2/3]O2의 개략도
나트륨 이온이 다른 구조에서 함량에 따라 나트륨 이온은 Mn과 Mg 사이의 쿨롱 상호작용에 영향을 받습니다. 전이금속층에는 Na이온이, 알칼리금속층에는 Na이온이 존재하는 것을 보여주고 있다. 두 가지 다른 점령 모드. 따라서 이 연구에서는 먼저 쿨롱을 사용합니다. P2 단계 Na0.67[Mg0.33Mn0.67]O2 구성을 신속하게 걸러내는 모델 쿨롱 에너지가 가장 낮습니다. 합리성을 검증하기 위해, 이러한 선별된 구성의 XRD 패턴을 계산하고 시뮬레이션했으며 측정된 결과와 비교하였다[11]. 결과가 표시됩니다. 그림 2에서 계산된 (016)과 (110)은 오른쪽으로 약간 이동합니다. 주로 다음과 같은 이유로 인해 실험적 특성화와 비교됩니다. 일부 결정면에는 비정질 및 결함 구조가 존재합니다. 실험적으로 준비된 재료. 계산 모델의 구조는 다음과 같습니다. 완벽한 결정 구조이므로 XRD 사이에 일정한 편차가 있습니다. 계산 시뮬레이션의 확장 및 피크 강도와 실험 결과. 또한, Na 이온이 배열되어 있습니다. 두 개의 결정면이 있고 Na 이온의 삽입과 분리는 또 다른 것입니다. 해당 피크 위치가 이동하는 가능한 이유. 후에 위의 효과를 고려하여 시뮬레이션된 피크 모양과 강도 XRD는 실험 결과와 일치하며 구성된 모델은 실험에서 미세 구조 정보를 재현하여 이론적으로 검증된 구조는 상대적으로 정확하고 신뢰할 수 있습니다[31,32].
![Fig. 2 Comparison of calculated and experimental XRD patterns of Na0.67[Mg0.33Mn0.67]O2 Fig. 2 Comparison of calculated and experimental XRD patterns of Na0.67[Mg0.33Mn0.67]O2](/js/htmledit/kindeditor/attached/20231108/20231108103050_54123.webp)
그림. 2 계산된 XRD와 실험적 XRD 비교 Na0.67[Mg0.33Mn0.67]O2의 패턴
Mg 고체의 효과를 연구하기 위해 구조적 안정성에 대한 솔루션을 구축하기 위해 우리는 다음과 같은 첫 번째 원칙을 사용했습니다. 격자 진동 스펙트럼을 계산하는 "동결 포논 방법" P2-NaMnO2 및 P2-Na[Mg0.33Mn0.67]O2. 그림 3과 같이 소유자 웨이브 전체 Brillouin 구역에는 가상 주파수가 없으며 이는 다음을 나타냅니다. P2-Na[Mg0.33Mn0.67]O2는 동적 안정성을 가지고 있습니다. 포논 스펙트럼을 비교함으로써 두 재료 모두 Mg 도핑이 크게 변화하지 않는 것으로 나타났습니다. 진동 주파수 범위는 격자 진동에 거의 영향을 미치지 않았습니다. 그만큼 Mg 도핑된 구조는 또한 우수한 동적 안정성을 보여주었습니다. 또한 브루스 등 알. Mg 고용체를 사용하여 P2 상 Na[Mg0.33Mn0.67]O2를 성공적으로 제조했으며, 이는 재료에 추가적인 열역학적 특성이 있음을 추가로 입증했습니다. 안정. 그러므로 P2-Na[Mg0.33Mn0.67]O2가 구조적 안정성이 좋습니다.
![Fig. 3 Phonon dispersion curves of (A) NaMnO2 and (B) Na0.67[Mg0.33Mn0.67]O2 Fig. 3 Phonon dispersion curves of (A) NaMnO2 and (B) Na0.67[Mg0.33Mn0.67]O2](/js/htmledit/kindeditor/attached/20231108/20231108103102_42296.webp)
그림. 3 (A) NaMnO2 및 (B) Na0.67[Mg0.33Mn0.67]O2의 포논 분산 곡선
2.2 전기화학적 특성 분석 P2 상 Nax[Mg1/3Mn2/3]O2
Mg 도핑의 효과를 연구하기 위해 재료의 전기화학적 특성에 대해 방전량을 계산했습니다. Mg 고용체 구조 P2-Nax[Mg0.33Mn0.67]O2의 전압(그림 4). 그만큼 Na 이온의 농도 범위는 실험적으로 결정됩니다. 0.11…x…0.66[11]. 그림 4(A)는 구조적 변화를 보여줍니다. 방전 과정 및 해당 전압(그림 4(B))은 주로 다음을 포함합니다. 세 가지 플랫폼: 3.4, 2.9 및 2.1V. 예상 이론적 용량은 152입니다. mAh/g은 기본적으로 실험 결과와 일치합니다[11]. 첫 번째 원리에 따라 계산된 방전 전압 곡선은 약간 실제 측정 결과보다 높습니다. 가장 큰 이유는 첫 번째 원리 계산은 실험 측정의 영향을 무시합니다. 전해질, 리튬이온 전도도 등의 조건 실험 측정 온도 등. 우리의 이전 연구에 따르면[33] 계산된 방전 전압 곡선은 방전 전압 곡선보다 높지만 실험적으로 측정된 곡선에서는 전반적인 변화 추세가 일관됩니다. 따라서 전체 방전 과정에서 Nax[Mg0.33Mn0.67]O2의 전압은 실험 결과와 일치한다[12,20]. x<66%일 때, Nax[Mg0.33Mn0.67]O2는 약 3.0V의 고전압을 가지며, 명백한 추가 전압 플랫폼은 없습니다. 이는 Mn3+를 Mg2+로 대체하면 나트륨 이온 재배열을 억제하는 효과가 있음을 나타냅니다. 구조적 위상 변화. NaMnO2 및 기타 시스템에 대한 이전의 충전 및 방전 연구에서는 전이 금속의 규칙적인 배열이 일반적으로 더 많은 전압 플랫폼을 수반한다는 것을 발견했습니다.
![Fig. 4 (A) DFT-calculated structural changes and (B) discharge voltage curve of P2-Nax[Mg0.33Mn0.67]O2 during discharge Fig. 4 (A) DFT-calculated structural changes and (B) discharge voltage curve of P2-Nax[Mg0.33Mn0.67]O2 during discharge](/js/htmledit/kindeditor/attached/20231108/20231108103110_90088.webp)
그림. 4 (A) DFT 계산된 구조 변화 및 (B) 방전 중 P2-Nax[Mg0.33Mn0.67]O2의 방전 전압 곡선
이상적인 상황에서 원자가는 Na2/3[Mg0.33Mn0.67]O2의 Mg 및 Mn 상태는 각각 +2 및 +4이며, 더 높은 원자가 상태로 계속 산화될 수 없습니다. 따라서 시스템의 양이온 전기화학적 활동, 그리고 충전과 방전 재료의 과정은 음이온 전기화학 반응입니다. Na0.67MnO2에서는, Mn 이온의 초기 원자가 상태는 +3.33입니다. 충전 과정에서 Mn 이온은 0.67개의 전자를 외부로 전달하여 +4의 안정적인 원자가에 도달할 수 있습니다. ~에 이번에는 Na+가 모두 방출되었으며 격자 산소는 한 번도 방출되지 않았습니다. 전기화학반응에 참여했다[34]. 그러므로, Na0.67MnO2의 충방전 과정은 양이온으로 나타남 전기화학 반응. 많은 연구에 따르면 숫자가 많을 때 격자 산소에 의해 손실된 전자는 0.33 미만이며, 음이온 전기화학 반응은 가역성이 좋다[11-12,28]. 과도한 산화 산소 음이온(잃어버린 전자의 수가 0.33보다 큼)이 st에서 벗어난 산소의 전자 배치유능한 8 커플러 규칙, 돌이킬 수 없는 변환 반응을 일으키고 O-O 채권. 산소 발생과 비가역적 전하로 이어질 수도 있습니다. 전극구조의 방전[27,35]. ~ 안에 Na0.67[Mg0.33Mn0.67]O2, 전하 손실의 한계 상태를 고려하는 경우. 저것 즉, Na 이온이 완전히 분리되어 Na0[Mg0.33Mn0.67]O2를 형성하는 경우입니다. 구조에서 Mg와 Mn은 항상 +2와 +4 원자가를 유지합니다. O 음이온은 -1.67 원자가로 산화되어 한계보다 낮은 0.33 전자를 잃습니다. 비가역적 음이온 전기화학 반응. 그러므로 전체적으로 c Na0.67[Mg0.33Mn0.67]O2의 하징 반응, 격자 산소가 필요하지 않음 공간적으로 재구성되고, 전기화학적 반응은 가역적이다. Mg2+의 도입으로 가역적 비용량을 유지할 뿐만 아니라, 뿐만 아니라 물질의 에너지 밀도도 증가시킵니다. 방전전압.
전기화학을 증명하기 위해 방전 중 Nax[Mg0.33Mn0.67]O2 물질의 산소 활성 프로세스에서 우리는 전자 상태 밀도(그림 5)를 계산했습니다. 재료의 초기 및 최종 방전 구조. 그것은 발견되었다 방전 과정에서 Na 이온이 점차적으로 매립되어 전체 수 시스템의 전자 수가 증가하고 페르미 준위가 더 높은 수준으로 이동했습니다. 에너지 수준. O2p 궤도의 구멍 수가 점차 감소하고, 이는 시스템에 들어오는 전자가 빈 시스템으로 전달됨을 나타냅니다. 격자 산소의 궤도가 바뀌고 격자 산소가 감소합니다. 동안 전극 재료의 방전 과정에 격자 산소가 참여합니다. 음이온의 전기화학적 반응. 이때는 거의 변화가 없습니다. Mn-d 궤도 전자에서는 전하 이동이 없습니다. Mn의 원자가 상태는 방전 과정에서 변하지 않습니다. Mn은 전기화학적 활성이 없습니다[12,36]. 그러나, P2-NaxMnO2의 방전 과정에서 전자는 계속해서 고에너지 Mn을 채웁니다. 및 O 빈 궤도는 Mn과 O가 모두 전기화학적으로 있음을 나타냅니다. 활성을 가지며 음이온과 양이온이 협력하는 전형적인 전기화학 반응입니다.
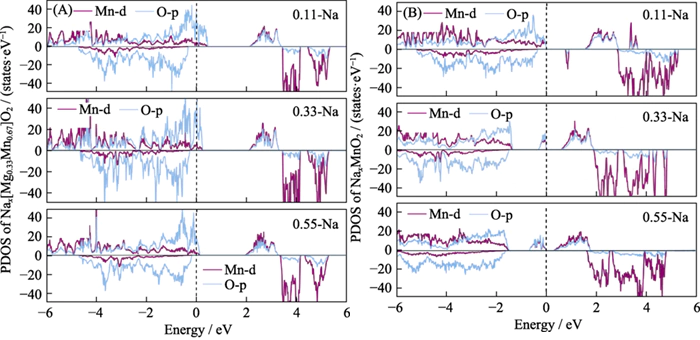
그림. 5 다른 Na 이온 하에서 (A) P2-Nax[Mg0.33Mn0.67]O2 및 (B) P2-NaxMnO2 상태의 전자 밀도 퇴원시 내용물
PDOS: 예상됨 상태 밀도
일관된 결론을 내릴 수 있다 전하 모집단 분석을 통해(그림 6) 퇴원 과정에서 Nax[Mg0.33Mn0.67]O2, Mn 이온의 전하량은 기본적으로 변하지 않으므로 전기화학 반응에 참여하지 않습니다. 그 과정에서 Na 함량을 0.11에서 0.66으로 증가시키면 O 이온은 약 0.2e-를 얻습니다. 음이온 전기화학 활성을 나타내는 상당한 전하 충전이 발생했습니다[37]. P2-NaxMnO2의 전하밀도분석을 통해 알아냈습니다. Na 함량이 증가함에 따라 Mn과 O가 공동으로 참여합니다. 전기화학 반응. 이 결과는 다음의 분석과 일치한다. 전자 상태 밀도. Mg의 고용체가 증명되었다. 시스템의 전기화학적 반응 메커니즘을 음이온에서 변화시키고 양이온 가역적 음이온에 대한 협력 전기화학 반응 전기 화학 반응 및 이 과정은 전하에 영향을 미치지 않습니다. 재료의 방전 가역성
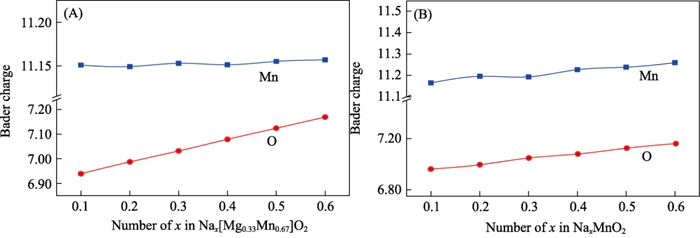
그림. 6 요금 서로 다른 나트륨 이온 하에서 (A) Nax[Mg0.33Mn0.67]O2 및 (B) P2-NaxMnO2 분석 내용
3 결론
본 연구에서는 제1원리를 사용하였다. 미세구조적 특성을 체계적으로 연구하기 위한 계산, Mg2+ 고용체 P2의 역학적 안정성과 전기화학적 활성 상 Nax[Mg1/3Mn2/3]O2. Mg2+의 도입으로 전기화학적 변화가 발생합니다. 음이온 및 양이온 협동체로부터 나오는 물질의 반응 유형 가역적 음이온 전기화학에 대한 NaxMnO2의 전기화학적 반응 Nax[Mg0.33Mn0.67]O2의 반응. P2-Nax[Mg0.33Mn0.67]O2에 O 음이온이 있을 때 전기화학 반응에 참여하면 전하 증가 및 손실 범위는 다음과 같습니다. 0.33 미만으로 가역성이 좋습니다. Mg2+의 도입뿐만 아니라 재료의 방전 전압을 증가시킬 뿐만 아니라 재료의 가역적 비용량은 궁극적으로 증가합니다. 재료의 에너지 밀도.
나트륨이온 전극재료에 있어서, 전이 충족에 알칼리 토금속을 도입하는 것양이온을 위한 알루미늄 층 솔리드 솔루션은 신소재 성능 최적화 전략입니다. 그 기본 메커니즘은 음이온의 전기화학적 활동을 희생하여 촉발하는 것입니다. 양이온의 전기화학적 활동, 전기화학적 반응 변화 재료의 메커니즘으로 인해 방전 전압이 증가하고 궁극적으로 재료의 에너지 밀도를 최적화합니다. 이 전략은 다음을 제공할 뿐만 아니라 나트륨이온전지용 전극소재 설계의 새로운 방법 뿐만 아니라 다른 이온의 최적화 및 탐색을 위한 새로운 아이디어도 제공합니다. 배터리.
참고자료
[1] HU YING-YING, WEN ZHAO-YIN, RUI-KUN 등 알. 최첨단 나트륨전지 연구개발 현황입니다. 에너지 저장 과학기술, 2013,2(2):81-90.
[2] SHEN GUAN-YE, LI CHEN, XU BING-LIANG 등 알. 경제적 배분 풍력을 고려한 에너지 저장 시스템을 위한 것입니다. 동북 저널 전력대학, 2018,38(4):27-34.
[3] MA CHAO, ZHAO XIAO-LIN, KANG LI-TAO 등 알. 비공액 전기화학전지용 디카르복실산 음극소재. 앤쥬. 화학. 국제 Ed., 2018,57(29):8865-8870.
[4] 리차드 W D, DACEK S T, KITCHAEV D A, 외. 불소화 리튬 과량 전이금속 산화물 양극재. 첨단에너지 자료, 2018,8(5):1701533.
[5] XIANG XING-DE, ZHANG KAI, CHEN JUN. 최근의 발전과 나트륨이온전지 양극재 전망. 고급 Mater., 2015,27(36):5343-5364.
[6] 마차오, 자오샤오린, 해리스 M M, 외. 요산 나트륨 이온 배터리용 전기화학적 활성 화합물: Ώ-공액 및 안정화된 탄소 음이온의 단계적 Na+ 저장 메커니즘. ACS 응용 재료 & 인터페이스, 2017,9(39):33934-33940.
[7] 이 D H, XU JING, MENG Y S. 고급 음극 높은 율과 우수한 구조적 안정성을 갖춘 Na-ion 배터리용 제품입니다. 물리. 화학. 화학. Phys., 2013,15(9):3304-3312.
[8] KUBOTA K, YABUUCHI N, YOSHIDA H 등 알. 층상 산화물 Na 이온 배터리용 양극 재료. MRS 게시판, 2014,39(5):416-422.
[9] 클레멘트 RJ, BRUCE P G, GREY C P. 리뷰...망간- 나트륨 이온 배터리 음극 소재로 P2 형 전이 금속 산화물을 기반으로합니다. 저널 전기화학학회, 2015,162(14):A2589-A2604.
[10] BERTHELOT R, CARLIER D, DELMAS C. 전기화학 P2-NaxCoO2 단계 다이어그램 조사. Nat. Mater., 2011,10(1):74-80.
[11] YABUUCHI N, HARA R, KUBOTA K 등 알. 새로운 전극 충전용 나트륨 배터리 소재: P2형 Na2/3[Mg0.28Mn0.72]O2가 비정상적으로 높음 가역적 용량. J. Mater. 화학. A, 2014,2(40):16851-16855.
[12] MAITRA U, 하우스 R A, SOMERVILLE JW, 외. 산소 산화환원 Na2/3[Mg0.28Mn0.72]O2에 과도한 알칼리 금속 이온이 없는 화학. Nat. Chem., 2018,10(3):288-295.
[13] GUO SHAO-HUA, SUN YANG, YI JIN 등 알. 이해 실험을 통한 층상 P2 및 P3 산화물의 나트륨 이온 확산 그리고 첫 번째 원리 계산: 결정 구조와 전기화학적 성능. NPG 아시아 재료, 2016,8:e266.
[14] 지희웨이, 키차예프 D A, LUN ZHANG-YAN, 외. 전산 무질서한 고용량 리튬이온의 조사 및 실험적 구현 Ni 산화 환원을 기반으로 한 음극. 화학 자료, 2019,31(7):2431-2442.
[15] LEE J, URBAN A, LI XIN 등 알. 잠금 해제 재충전 가능한 리튬 배터리에 대한 양이온 무질서 산화물의 잠재력. 과학, 2014,343(6170):519-522.
[16] URBAN A, LEE J, CEDER G. 구성 고용량 리튬 배터리 전극을 위한 암염형 산화물의 공간. 첨단에너지 자료, 2014,4(13):1400478.
[17] CHAKRABORTY A, DIXIT M, AURBACH D 등 알. 정확한 예측 SCAN Meta-GGA 밀도를 이용한 층상 산화물 재료의 음극 특성 기능적. npj 계산 자료, 2018,4:60.
[18] URBAN A, ABDELLAHI A, DACEK S 등 알. 전자구조 전이금속 산화물의 양이온 장애의 기원. 물리. Lett., 2017,119(17):176402.
[19] ASSAT G, TARASCON J M. 기초 리튬이온의 음이온 산화환원 활동에 대한 이해와 실제적 과제 배터리. 네이처 에너지, 2018,3(5):373-386.
[20] YABUUCHI N, NAKAYAMA M, TAKEUCHI M, et 알. 유래 산화물 이온의 고체 산화환원 반응의 안정화 및 불안정화 리튬이온 배터리용. Nat. Commun., 2016,7:13814.
[21] SANNYAL A, AHN Y, JANG J. 제1원리 양극재인 2차원 실리겐(2D SiGe)에 대한 연구 알칼리 금속 이온 배터리. 전산 재료과학, 2019,165:121-128.
[22] LI HONG, HU YONG-SHENG, PAN HUI-LIN 등 알. 연구 진행 상황 상온 나트륨 이온 저장 배터리의 전극 재료 구조. 사이언티아 시니카 치미카, 2014,44(8):1269-1279.
[23] WANG YUE-SHENG, XIAO RUI-JUAN, HU YONG-SHENG 등 알. P2-Na0.6[Cr0.6Ti0.4]O2 양이온 장애 전극 고속 대칭 충전식 나트륨 이온 배터리용. Nat. Commun., 2015,6:6954.
[24] WANG QIN-CHAO, MENG JING-KE, YUE XIN-YANG 등 알. P2 구조 튜닝 Na-이온 배터리를 Na-site Mg로 치환한 양극재. J.Am. 화학. Soc., 2019,141(2):840-848.
[25] MENDIBOURD A, DELMAS C, HAGENMULLER C. 전기화학 NaxMnO2 청동의 삽입 및 탈삽입. 학술 출판사, 1985,57(3):323-331.
[26] 서머빌 J W, SOBKOWIAK A, TAPIA-RUIZ N 등 성격 층상 Na 이온 배터리 음극의 ...Z...상. 에너지 & 환경과학, 2019,12(7):2223-2232.
[27] QU JIE, WANG DONG, YANG ZU-GUANG 등 알. 이온도핑- 부위 변화에 따른 복합 음극 조정: 사례 연구 Na/Mn 사이트에서 Mg2+ 도핑을 사용한 레이어 터널 Na0.6MnO2. ACS 응용 프로그램. 교배. 인터페이스, 2019,11(30):26938-26945.
[28] 사토 T, 사토 K, ZHAO WEN-WEN 등 알. 준안정적이고 나노크기 양이온 무질서 암염형 산화물: 화학량론의 재검토 LiMnO2 및 NaMnO2. 재료 저널 화학 A, 2018,6(28):13943-13951.
[29] GUIGNARD M, DELMAS C. 배터리를 사용하여 새로운 바나듐 산화물을 합성합니다. 화학 선택, 2017,2(20):5800-5804.
[30] 왕펑페이, 야오후롱, 리우신위, , 외. Na+/ 공극 장애는 고속 Na 이온 배터리를 약속합니다. Science Advances, 2018, 4(3): eaar6018.
[31] 김H, 김 D J, SEO D H, 외. 나트륨 이온 배터리에 대한 Na0.44MnO2의 나트륨 층간 삽입 및 중간 단계에 대한 기초 연구입니다. 화학 자료, 2012,24(6):1205-1211.
[32] LI XIN, MA XIAO-HUA, SU DONG 등 알. 직접적인 시각화 Na5/8MnO2의 Na 순서와 결합된 Jahn-Teller 효과. Nat. Mater., 2014,13(6):586-592.
[33] WANG YOUWEI, WANG JUNKAI, ZHAO XIAOLIN 등 알. 요금 절감 밴드 정렬 음극 설계를 통해 Li-O2 배터리의 과전압. 에너지 & 환경과학, 2020,13(8):2540-2548.
[34] ZHENG C, RADHAKRISHNAN B, CHU I H, 외. 효과 Na 정렬 및 동역학 층상 P2 산화물에 대한 전이 금속 혼합. 물리적 검토 출원, 2017,7(6):064003.
[35] LUN ZHENG-YAN, OUYANG B, CAI ZI-JIAN 등 알. 설계 원칙 고용량 Mn 기반 양이온 무질서 암염 음극. 화학, 2020,6(1):153-168.
[36] SEO D H, LEE J, URBAN A 등 구조적 및 층상 및 양이온 무질서의 산소 산화환원 활성의 화학적 기원 Li 과잉 음극재. Nat. Chem., 2016,8(7):692-697.
[37] BAI QIANG, YANG LU-FENG, CHEN HAI-LONG 등 알. 전산 연구 나트륨이온전지의 전극재료. 첨단에너지 자료, 2018,8(17):1702998.