이중 리튬염 젤 복합전해질: 리튬금속전지y에서의 제조 및 응용
궈 위샹, 황 Liqiang, WANG Gang, WANG Hongzhi. 이중 리튬 염 겔 복합체 전해질: 리튬 금속 배터리의 제조 및 응용. 저널 무기 재료, 2023, 38(7): 785-792 DOI:10.15541/jim20220761
초록
금속 Li는 고에너지 밀도 리튬 이온의 이상적인 양극 중 하나입니다. 이론 비용량이 높고 환원 가능성이 낮은 배터리 풍부한 매장량도 마찬가지다. 그러나 Li 양극의 적용에는 다음과 같은 문제가 있습니다. 기존 유기 액체 전해질과의 심각한 비 호환성. 여기서는 금속 Li과의 상용성이 만족스러운 겔 복합 전해질(GCE) 양극은 현장 중합을 통해 구성되었습니다. 더블 전해질에 도입된 리튬염 시스템은 전해질의 전기화학적 창을 넓혀주는 고분자 성분 상용 전해질의 3.92V에 비해 5.26V로 높은 이온성을 얻을 수 있습니다. 30…에서 1Ã10-3 S·cm-1의 전도성도 있습니다. 결과 Li 양극 표면의 형태 특성 분석 및 원소 분석 GCE는 리튬 금속에 대해 명백한 보호 효과를 나타냅니다. 이중 리튬염 시스템의 조건, 부피 효과 및 수상돌기 성장 Li 양극의 활성은 분명히 억제됩니다. 동시에, 리튬 금속 전체 상용 리튬인산철(LiFePO4) 양극재로 조립된 배터리, 뛰어난 사이클링 안정성과 속도 성능을 나타냅니다. 용량 200사이클을 일정하게 유지한 후 배터리 유지율은 92.95%에 도달합니다. 25…에서 전류 0.2C(1C = 0.67mA·cm-2) 이 연구는 GCE가 안전성, 안정성 및 포괄적인 측면을 효과적으로 향상시킬 수 있다는 점 리튬금속전지의 전기화학적 성능이 기대되는 보편적인 준고체 전해질 설계 전략을 제시한다.
키워드 ï¼ 금속성 Li; 현장 중합; 젤 복합체 전해질
'더블카본'이라는 목표가 세워진 이후 2020년 중국은 전례 없는 에너지 시스템 개혁에 직면해 있다. 중국 향후 30년 안에 탄소 배출을 대폭 줄여야 합니다. 그리고 녹색 에너지는 '독점'을 대체할 때까지 점차 강화될 것입니다. 전통적인 화석에너지의 입장. 재생 에너지의 중요한 부분으로 에너지 시스템, 리튬 이온 배터리 기술이 널리 보급되었습니다. 일단 나왔으니 주목하세요. 현재는 주 에너지원이외에 3C 전자 제품의 장치, 리튬 배터리의 응용 자동차산업, 항공우주, 스마트그리드 분야는 점차 증가하여 성능에 대한 요구 사항이 높아집니다. ~ 안에 더 긴 항속 거리를 확보하려면 전원 리튬 배터리가 필요합니다. 에너지 밀도가 더 높은 배터리 시스템을 개발합니다. 그 중 리튬금속은 초고비용량(3860 mAh g-1)과 낮은 환원전위 (-3.04 V (vs SHE))가 차세대 음극소재로 기대 에너지 밀도가 높은 배터리. 그러나 리튬 금속이 접촉되면 유기 액체 전해질에서는 부반응이 계속해서 발생합니다. 리튬 수상돌기의 제어할 수 없는 성장으로 이어지는 인터페이스 배터리 내부 분리막으로 인해 단락이 발생하고 심지어 안전합니다. 문제. 이 결함에 대응하여 일반적으로 고체를 사용하는 것으로 간주됩니다. 액체전해질 대신 전해질을 사용하여 배터리의 안전성을 높였습니다. 그러나 실온이 낮고 이온 전도성이 낮고 계면이 좋지 않습니다. 호환성은 향후 개발 및 적용을 심각하게 방해합니다.
이러한 배경에서 겔상태(gel-state) 계면 접촉과 이온 전도도의 균형을 맞출 수 있는 전해질 점점 더 주목을 받게 되었습니다. Tan Shuangjie 등이 개발한 난연제를 고정화하여 불연성 겔상 전해질 높은 폴리비닐렌 카보네이트 폴리머 매트릭스의 유기인산염 기계적 강도. 전해질은 이온성이 높다는 장점이 있습니다. 전도성 및 리튬이온 전달수, 불연성, 높은 기계적 특성 강도가 좋고 전기화학적 호환성이 좋다. 게다가 젤은 in-situ 중합에 의해 배터리 내부에 형성된 전해질은 점도가 낮고 취급이 용이하며 젖음성이 강한 특성을 가지고 있으며, 활물질에 완전히 침투하여 이상적인 계면을 생성할 수 있는 접촉시켜서 좋은 이온 이동 경로를 얻습니다. 예를 들어 궈위궈(Guo Yuguo)의 연구팀은 전통적인 에테르 기반의 단량체인 1,3-디옥솔란(1,3-Dioxolane, DOL)과 1,2-디메톡시에탄(1,2-Dimethoxyether, DME), 상업용 리튬 리튬염인 헥사플루오로인산염(LiPF6)은 고리 열림을 유발할 수 있습니다. DOL의 중합과 동시에 새로운 겔상 전해질을 리튬-황 배터리 및 상용 양극 배터리에서 안정적으로 작동 가능 획득되었습니다. 폴리에테르 기반 폴리머는 가장 안정적인 폴리머 중 하나이지만 리튬 금속 양극용 전해질, 좁은 전기화학적 창 및 실온에서 낮은 이온 전도도는 고에너지에서의 적용을 제한합니다. 밀도 배터리. LiPF6는 이상적인 이온 전도도와 뛰어난 전극 호환성이 좋지 않아 전기화학적 안정성이 떨어지는 문제가 있습니다. 따라서, 우수한 포괄성을 지닌 겔상 전해질을 개발하고자 한다. 성능을 높이려면 적합한 폴리머 호스트, 리튬염을 선택해야 합니다. 및 기타 구성 요소.
관계의 균형을 이루기 위해 전도성, 고전압 안정성 및 전극 호환성, 본 연구에서는 고체-액체 복합 고성능 GCE가 개발되었습니다. 그만큼 열 개시형 in-situ 중합법을 채택하였고, PEGDA를 사용하였다. 단량체로는 에틸렌카보네이트와 디에틸카보네이트의 혼합용매를 사용하였다. 이중 리튬염 시스템으로 LiTFSI와 LiDFOB가 도입되었습니다. 폴리머 구성 요소와 함께 작동합니다. 개선하면서 전기화학적 성능, 전해질 사이의 계면 안정성 리튬 금속 음극이 더욱 강화되었습니다.
1 실험방법
1.1 GCE 준비
LiTFSI, LiDFOB, EC 및 DEC(쑤저우 듀오두오) Chemical Technology Co., Ltd.)는 모두 무수등급 배터리 소재입니다. 그만큼 EC와 DEC 시약을 혼합하고 LiTFSI와 LiDFOB의 무게를 측정하고 용매에 용해. 제조된 이중염계 전해질(액체) 전해질, LE)는 1 mol/L LiTFSI의 EC/DEC(부피비 1:1) 용액이었습니다. 및 0.2mol/L LiDFOB. PEGDA(∼99%, Mn=400) 및 아조비스이소부티로니트릴 (Azodiisobutyronitrile, AIBN, 98%)은 Shanghai Aladdin Reagent에서 구입했습니다. (주)GCE의 전구체 용액은 PEGDA와 LE를 혼합하여 제조하였고, PEGDA의 질량분율은 10%, 20%, 30%였다. 1% 질량 분율을 추가합니다. 열개시제 AIBN을 넣고 잘 저어줍니다. PEGDA 전구체 용액을 가열했습니다. 완전히 중합된 PEGDA 기반 겔 복합체를 얻기 위해 70°C에서 2시간 동안 GCE-x(x=10, 20, 30)로 명명된 전해질. 위의 실험은 모두 무수 및 무산소 글러브 박스에서 수행됩니다.
1.2 배터리 조립
CR2025 버튼 셀의 배터리 어셈블리(316 스테인레스 스틸, SS), 리튬 금속 시트(14 mmø0.45 mm, Li), 알루미늄 호일 (배터리 등급). 다양한 테스트 요구 사항에 따라 SS||SS 배터리, Li||SS 배터리, Li||Li 배터리 및 Li||LiFePO4 배터리가 조립되었습니다. 글러브 박스. LiFePO4, Ketjen Black 및 폴리비닐리덴의 질량비 양극재의 이불화물(PVDF)은 90:5:5이며, 면적용량은 0.67mAh·cm-2입니다. 준비에 대한 자세한 내용은 보충 자료 S1을 참조하십시오. 양극시트 공정 및 전지 조립공정
1.3 재료의 특성화 방법
작용기 및 화학물질 PEGDA 단량체와 그 중합체의 구조는 Thermo를 사용하여 분석되었습니다. NiColet iS50 푸리에 변환 적외선 분광계(푸리에 변환 Thermo Fisher Scientific Corporation의 적외선 분광계(FT-IR) 미국, 파장 범위 400-4000 cm-1. 결정 성 폴리머 함량이 다른 젤 상태 전해질의 특징은 다음과 같습니다. Bruker AXS의 D2 Phaser X선 회절계(X선 회절계, XRD) Company, Germany, 스캐닝 범위는 2θ=5°~80°였습니다. OCA40Micro 접점 Beijing Dongfang Defei Instrument Co., Ltd.의 각도 측정 장치는 다양한 PEGDA를 사용하여 전구체 용액의 접촉각을 테스트하는 데 사용됨 LiFePO4 전극 시트 표면의 함량. 미세한 형태 리튬 금속 시트의 단면과 표면을 관찰한 결과 JElectronics JSM-7500F 전계방출형 주사전자현미경(Field 방출 주사 전자 현미경, FESEM). 에 대한 원소 정보는 Escalab 250Xi X-ray를 이용하여 리튬 금속 시트의 표면을 분석하였습니다. Thermo의 광전자 분광계(X선 광전자 분광학, XPS) 미국 Fisher Scientific Corporation.
1.4 전기화학적 시험
전기화학적 안정성 창 전해질은 선형 스위프 볼타메트리(LSV)로 테스트되었으며 전압 범위는 다음과 같습니다. 개방 회로 전압(OCV)에서 6V까지, 스윕 속도는 1mV·s-1이었습니다. 그만큼 EIS(Electrochemical Impedance Spectroscopy)의 주파수 범위는 10-2~106Hz이며, 섭동 전압은 10mV입니다. Chronoamperometry를 사용하여 측정했습니다. 전해질에서 리튬 이온의 이동 수, 전위 차이는 10mV로 설정되었고 시간은 800초였으며 마이그레이션 횟수는 리튬이온은 하기 식(1)에 따라 구해진다:
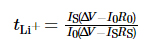
이 중 tLi+는 리튬 이온, ΔV는 전위차, R0 및 RS는 인터페이스 테스트 전후의 전극과 전해질의 임피던스 값, I0와 IS는 각각 초기 상태 전류와 정상 상태이다. 각각 현재. 위 테스트는 모두 PARSTAT MC에서 진행되었습니다. 미국 AMETEK의 다중채널 전기화학 워크스테이션. 충방전 사이클 성능 배터리는 우한의 LAND CT3001A-1U 배터리 테스트 플랫폼을 사용하여 테스트되었습니다. 랜디안전자(주)
2 결과 및 논의
2.1 이물질의 제조 및 구조분석 GCE
본 연구에서는 PEGDA를 단량체로 사용하였고, 중합개시제로 AIBN을 사용하였고, EC와 DEC를 중합개시제로 도입하였다. 가소제. 가교결합된 고분자를 가진 겔상태 전해질 폴리에틸렌 글리콜 디메타크릴레이트(p(PEGDA))는 70℃에서 합성되었습니다. 그만큼 중합 반응식은 그림 1(a)에 나타내었다. 추가한 후 열 개시제 AIBN, 2개의 활성 말단 C=C 그룹이 있는 PEGDA를 빠르게 70°C로 가열하면 분자간 단독중합이 일어납니다. 활성 AIBN의 사슬은 분자 사슬을 서로 연결하거나 내부적으로 연결하게 하며, 최종적으로 p(PEGDA) 네트워크 골격 구조를 획득하고 성공적으로 겔 상태 전해질을 얻기 위해 현장 중합 방법을 사용 배터리 내부. 그림 S1에 표시된 것처럼 세 가지 전구체 솔루션은 다양한 PEGDA 함량은 모두 LiFePO4 양성에서 우수한 습윤성을 나타냈습니다. 전극 시트는 사이의 좋은 계면 접촉을 얻는 열쇠입니다. 전해질과 전극.
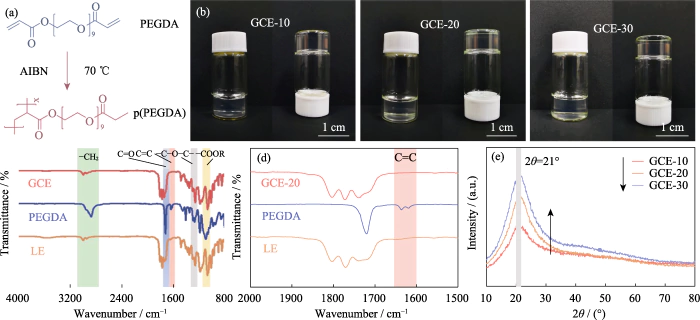
그림. 1 GCE의 준비 및 구조 분석
(a) 중합 PEGDA의 반응; (b) GCE-x의 광학 사진; (c, d) FT-IR GCE-20, PEGDA 및 LE의 스펙트럼; (e) GCE-x의 XRD 패턴; 화려한 수치는 웹사이트에서 확인할 수 있습니다
높은 이온성을 갖는 GCE를 얻기 위해서는 고분자 내 해리도가 높은 전도성 LiTFSI, 리튬염으로 0.2 mol/L LiDFOB를 도입하여 구축하였다. 이중염 시스템의 겔 네트워크. LiDFOB는 용해도가 좋고 특히 필름 형성 특성의 열 안정성. 탄산일 때 용매는 리튬 금속 양극과 접촉하고 있으며 다수의 느슨한 다공성 또는 수지상 리튬 증착층이 형성될 가능성이 높습니다. 리튬 금속 표면. LiDFOB의 도입은 다음을 도울 수 있습니다. HF가 없는 고체 전해질 간기(Solid Electrolyte) 형성 Interphase, SEI) 층을 사용하여 리튬 금속 양극과의 호환성을 향상시킵니다. 동시에, LiTFSI는 금속 집전체에 부식 효과를 가지며, LiDFOB는 알루미늄 금속을 부동태화하고 부식 효과를 완화할 수 있습니다. 전류 수집기의 LiTFSI. 그러나 LiDFOB의 단일염 전해질은 LiTFSI-LiDFOB 이중염 전해질보다 더 높은 임피던스를 나타냈다. 같은 농도. 그림 S2에서 볼 수 있듯이 Li||LiFePO4 배터리는 1.2 mol/L LiDFOB 및 LiTFSI-LiDFOB 겔 전해질을 사용하여 조립되었으며, LiTFSI-LiDFOB 배터리의 임피던스는 각각 상당히 높았습니다. 더 작습니다.
기존 연구 결과에 따르면 LiTFSI는 LiDFOB는 시너지 효과를 발휘하여 효과적으로 개선할 수 있습니다. 리튬 금속 양극과 전해질의 호환성. Jiao Shuhong 등 알. XPS와 FT-IR을 사용하여 LiTFSI의 이중염 전해질과 LiDFOB는 양극의 알루미늄 집전체를 부동태화할 수 있습니다. 리튬 금속 음극 표면에 안정적인 SEI 층을 형성합니다. 리튬 금속 배터리의 장기간 안정적인 사이클링을 달성하는 전극. ~에 이 기초, Liu Yue et al. [26]은 하이브리드 분자 역학 시뮬레이션을 사용하여 리튬 금속에서 LiTFSI와 LiDFOB의 결합 작용 메커니즘 연구 배터리, LiDFOB에 대한 LiTFSI의 보호 효과를 설명했습니다. 연구 LiDFOB의 B-O 결합은 상대적으로 가장 약하고 파손. LiDFOB는 자유 라디칼의 작용으로 빠르게 분해되며 리튬 금속과 반응하여 유리 Li2O 및 붕소 원자를 생성합니다. 붕소 원자 삽입 반응으로 인해 전해질의 용매 분자가 분해되고 생성된 분자 조각은 계속해서 다음과 반응합니다. 리튬염 분자 조각과 붕소 원자. 디리튬염 시스템에서는, 그러나 LiTFSI는 "희생"에 의존하여 우선적으로 분해됩니다. LiDFOB를 보호하기 위한 메커니즘"을 사용하면 LiDFOB의 분해 속도는 크게 감소했습니다. 이로써 자유 Li2O 및 붕소 원자의 수를 감소시키고, SEI 층을 최적화하고 리튬 금속 음극을 보호할 수 있습니다.
그림 1(b)와 같이 GCE-x는 균일하다. 더 이상 유동적이지 않은 투명한 젤리 같은 상태입니다. 모노머를 추가로 확인하려면 중합, FT-IR을 사용하여 LE의 화학 구조를 특성화했습니다. PEGDA 단량체 및 GCE-20. 그림 1(c)에 표시된 것처럼 세 가지 샘플 모두 C=O 신축 진동의 일반적인 흡수 피크(~1726cm-1). 그만큼 GCE의 1280cm-1 흡수 피크는 반대칭에 해당하며 에테르 결합의 대칭 신장 피크는 -(CH2CH2)n-을 나타냅니다. 단량체는 중합 중에 파괴되지 않습니다. 최고점은 1095이고 2867cm²1은 각각 -COOR 및 -CH2에 속합니다. 처럼 그림 1(d)에 표시된 것처럼 PEGDA의 C=C 결합의 특징적인 피크는 다음과 같습니다. 1616-1636cm-1에 위치하지만 GCE에서는 사라져서 PEGDA가 있음을 나타냅니다. 완전히 중합되었습니다.
리튬 이온은 내부에서만 이동하기 때문에 GCE의 비정질 영역은 전해질의 결정성을 감소시킵니다. 이온 전도도를 향상시키는 데 유리합니다. 그림 1(e)는 GCE-x. 세 가지 유형의 샘플 모두 고유한 회절 흡수 피크를 갖습니다. 2θ=21°에서, 준비된 전해질에 비정질 영역이 있음을 나타냅니다. 소량의 결정체가 동반됩니다. PEGDA의 내용으로는 증가하면 스펙트럼의 피크 면적이 크게 증가합니다. 겔 전해질의 비정질 영역의 비율이 감소하고, 전해질의 비정질 성분 함량이 감소합니다. 이온 이동에 도움이 됩니다.
2.2 GCE의 전기화학적 성능과 Li 금속 상용성 분석
호환성을 연구하기 위해 리튬 금속 양극을 사용한 다양한 폴리머 함량의 전해질 배터리, GCE-x를 사용한 Li||Li 대칭 배터리의 임피던스 스펙트럼 초기 상태의 전해질을 분석했습니다 (그림 S3 참조). 에서 그림에서 GCE-10 및 GCE-20 배터리의 인터페이스 임피던스 값은 다음과 같습니다. 둘 다 소형, 93 및 152 Ω이고 GCE-30 배터리는 409 Ω에 도달합니다. 이는 폴리머 함량이 더 높은 GCE에서 리튬 이온의 이동이 필요함을 보여줍니다. 빠른 이민에 도움이 되지 않는 더 큰 이주 장벽을 극복하기 위해 계면에서 리튬 이온의 전도.
Li||Li의 과전압 관찰 충전-방전 주기 테스트에서 대칭 배터리의 잠재력을 알 수 있습니다. 이 과정에서 이온쌍 이동에 의해 생성된 차이를 리튬 증착/박리 거동을 평가합니다. 그림 S4는 GCE-x의 Li||Li 대칭 셀의 전압-시간 곡선. 시험 온도 25…이고 배터리는 일정한 전류로 충전 및 방전되었습니다. 0.5mAh cm-2의 특정 용량과 0.5mA cm-2의 전류 밀도를 갖습니다. Li|GCE-10|Li 셀의 초기 과전위는 22mV였으며 전압은 250시간 후에 137mV로 증가했습니다. GCE-30 대칭의 과전압 배터리는 초기에 104mV였으며, 과전압은 급격히 증가했습니다. 후속 사이클에서는 227시간 만에 509mV의 피크 값에 도달한 다음 급격하게 떨어졌으며 이는 배터리에 내부 단락이 있음을 나타냅니다. ~ 안에 대조적으로, GCE-20 배터리는 30mV 근처의 낮은 과전위에서 작동할 수 있습니다. 가장 안정적인 전기화학적 성능을 가지고 있습니다. 다음 내용에 중점을 둘 것입니다. GCE-20 전해질.
전해질의 이온 전도도 전기장에서 이온이 이동하는 능력을 직접적으로 반영합니다. 그만큼 LE 및 GCE-20의 이온 전도도는 60, 50, 40, 30, 20, 10 및 0에서 테스트되었습니다. ... 각각. 그림 2(a)에 나타난 바와 같이, GCE-20의 이온 전도도는 30°C는 1.00mS cm-1이고, 테스트 온도가 60°C로 상승하면 전도도는 1.39mS cm-1에 도달합니다. 활성화 에너지 때문이다. 테스트 온도가 증가하면 감소하고 운동 활동은 폴리머 사슬 세그먼트와 리튬 이온이 증가합니다. 그러나 이동속도는 폴리머 사슬 세그먼트의 온도는 명백히 온도의 영향을 받습니다. GCE-20 겔 전해질의 전도도는 전해질의 전도도보다 더 많이 변화합니다. 해결책.
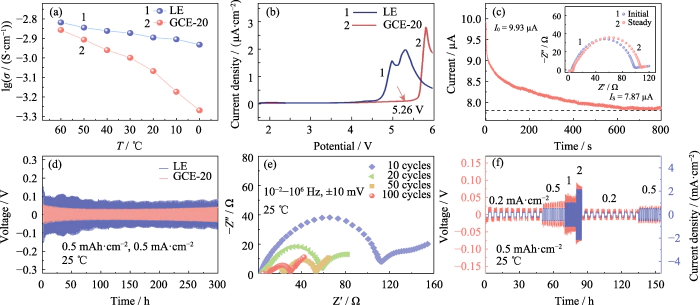
그림. 2 GCE-20의 전기화학적 성능
(a) 이온 LE 및 GCE-20의 전도성; (b) LE 및 GCE-20의 LSV 곡선; (기음) Li|GCE-20|Li 셀의 현재 시간 프로필(해당 내용 표시) 나이퀴스트 플롯; (d) 대칭형 Li||Li 셀의 전압-시간 곡선 LE 및 GCE-20; (e) 사이클링 후 Li|GCE-20|Li 셀의 나이퀴스트 플롯; (에프) Li|GCE-20|Li 셀의 전압-시간 및 전류 밀도-시간 곡선; 화려한 수치는 웹사이트에서 확인할 수 있습니다
배터리의 에너지 밀도 향상 높은 작동 전압에서 전해질의 안정성을 보장해야 합니다. 연구에 따르면 카르보닐 배위 폴리머 기반 전해질은 일반적으로 높은 작동에서 넓은 전기화학적 창과 우수한 안정성을 가집니다. 전압. 그림 2(b)는 GCE-20 배터리의 LSV 곡선이 5.26V에서 크게 변동하며, GCE-20 겔 전해질의 전기화학적 창은 5.26V에 도달합니다. 대조적으로, 상업용 전해질의 전기화학적 창은 3.92에 불과합니다. V. 따라서 겔상 전해질은 전기화학적 안정성이 우수하다. 고전압에서.
또한, 리튬이온 이동은 전해질의 양 역시 리튬을 측정하는 지표 중 하나입니다. 이온 전도성. 리튬이온수에 대한 비율로 정의됩니다. 방향에 수직인 전해질 단면을 통과하는 것 통과하는 음이온과 양이온의 합에 대한 단위 시간당 리튬 이온 이동 섹션을 통해. 값이 높을수록 리튬의 비율이 높아집니다. 이온 이동 과정에서 이온이 발생하고 이동 효율이 높아집니다. 그림 2(c)는 Li|GCE-20|Li 배터리의 대시간전류법 곡선입니다. 삽입된 내용은 배터리의 전기화학적 임피던스를 비교한 것입니다. 시험 전과 후. 식(1)에 따르면, 리튬 이온 이동수는 GCE-20의 값은 0.21입니다. 첨가제 도입 또는 무기 도핑 필러는 더 높은 리튬 이온 이동률을 얻을 수 있을 뿐만 아니라 배터리의 충전 및 방전 속도를 향상시키는 데 도움이 될 뿐만 아니라 사이클 안정성을 향상시킵니다.
충전 및 방전 과정에서 Li||Li 대칭 배터리의 경우 전해질의 음이온과 양이온이 반대 이주. 충전 시 리튬 이온이 음극으로 이동합니다. 전극과 음이온은 양극으로 이동하고 그 반대는 방전할 때 true입니다. 따라서 충전과 방전 과정에서 양극과 음극 사이의 이온 농도 구배 및 내장된 전기장이 점차 증가하여 반대 운동을 방해합니다. 음이온과 양이온이 결합하여 내부에서 농도 분극이 발생합니다. 배터리로 인해 과전압이 변경됩니다. 그림 2(d)에 나타난 바와 같이, Li|GCE-20|Li 배터리는 300분간 안정적인 사이클링 후 46mV의 과전압을 갖습니다. 시간. 그러나 테스트 중에 Li|LE|Li 배터리에 의해 생성된 과전압 Li|GCE-20|Li 배터리(65~118mV)보다 훨씬 높습니다. 이것 성장하는 리튬 수상돌기가 일부에서 소프트 단락을 일으키기 때문입니다. 내부 사이트. 결과는 내부의 전기화학적 거동을 보여줍니다. GCE-20 배터리가 더 이상적입니다. 그림 2(e)는 대칭형 EIS 테스트입니다. 10, 20, 50, 100사이클 후 배터리. 충방전 횟수만큼 사이클이 증가하면 배터리 임피던스가 감소하는 경향이 있습니다. 이 과정에서, 전해질과 리튬 금속 사이에 안정적인 SEI 층이 구축되었습니다. 인터페이스 및 인터페이스 접촉이 최적화되어 인터페이스가 임피던스가 크게 감소했습니다.
25…에서 Li|GCE-20|Li 배터리는 전류 밀도 0.2, 0.5, 1, 2에서 10회 충방전 주기를 거쳤습니다. 각각 0.2 및 0.5mA cm-2. 그림 2(f)는 이 과정에서 시간이 지남에 따라 대칭 셀의 과전압이 발생합니다. 그만큼 낮은 전류 밀도에서의 과전위는 작고 상대적으로 안정적으로 유지될 수 있습니다. 전류밀도가 증가하면 그에 따라 과전위도 증가하므로, 공정 중 전압의 급격한 증가/감소가 발생하지 않습니다.
리튬 시트 코팅의 형태 사이클링 후 증착/박리 동작을 시각적으로 특성화할 수 있습니다. 배터리 내부의 리튬. Li||Li 대칭 배터리는 이후 분해되었습니다. 0.5mAh cm-2 용량과 전류로 100시간 충방전 가능 0.5mA cm-2의 밀도, 단면의 미세한 형태 및 FESEM으로 리튬 금속 시트의 표면을 관찰하였다. 그림과 같이 그림 3(a, b)에서 처리되지 않은 순수 리튬 시트의 두께는 353μm이고, 표면이 평평하고 매끄 럽습니다. 액체 전해질과 전해질 사이의 상호 작용 리튬 금속은 느슨하고 다공성인 다수의 증착을 초래합니다. Li|LE|Li의 리튬 시트 표면에 리튬 증착층 배터리는 대부분 미세하고 울퉁불퉁한 이끼 모양입니다. 두께가 얇아지면 리튬 금속 시트가 446μm로 증가하면 부피가 확연히 늘어납니다. 효과가 있으며 많은 수의 수상돌기가 생성됩니다. 대조적으로, Li|GCE-20|Li 배터리의 리튬 시트 두께는 391μm이고, 표면증착층이 치밀하고 균일하며, 미세한 분할이 없음 리튬 코팅(그림 3(c)). 겔 상태 전해질이 가능하다는 것을 보여줍니다. 리튬 금속 양극의 부피 팽창을 효과적으로 억제합니다. LiDFOB GCE-20은 내부 균형을 맞추기 위해 안정적인 SEI 층 형성을 도울 수 있습니다. 배터리의 잠재력을 유도하여 리튬 수상돌기의 성장을 지연시킵니다. 리튬의 균일한 증착. 따라서 어느 정도 최적화할 수 있습니다. 리튬 증착/박리 거동을 개선하고 리튬 금속 양극을 보호합니다.

그림. 3 금속 Li의 SEM 이미지
단면(위) (a) 새로운 금속 Li 및 리튬 증착의 평면도(아래) SEM 이미지 (b) LE 및 (c) GCE-20를 갖는 대칭 Li||Li 세포의 형태
이어서 XPS 표면요소 분석 표면의 SEI 층 구성을 탐색하는 데 사용되었습니다. LiTFSI-LiDFOB 이중염 시스템의 작용으로 리튬 금속 양극 GCE. 그림 S5는 LE를 이용한 리튬 금속 음극 표면의 XPS 스펙트럼입니다. 및 GCE-20. C1s의 스펙트럼(그림 S5(a, d))은 주로 4개의 신호 피크를 가지며, 284.8 eV에서 C-C/C-H에 해당합니다. 286.4 및 289.4 eV의 두 피크 각각 C-O 및 C=O에 해당하며 주로 다음에서 파생됩니다. 탄산염 용매(예: ROCO2-, ROC- 등)의 분해 생성물. 그만큼 292.7eV의 피크는 CF3에 해당하며, 이는 주로 다음에서 파생됩니다. 리튬염의 분해산물. O1s 스펙트럼(그림 S5(b, e))에서, 531.1 및 532.3 eV의 피크는 각각 C=O 및 C-O에 해당하며, CO의 상대적인 함량이 크게 감소하는데, 이는 주로 관련이 있습니다. 분해산물의 함량이 감소합니다. 조인트 아래 LiTFSI 및 LiDFOB의 작용, LiOCH3, Li2O2C2H4 및 기타 형성 부산물이 제한됩니다. 추가LE(그림 S5(e))와 달리 F1에서는 GCE-20의 스펙트럼(그림 S5(f))에서 LiF의 신호 피크는 684.5eV이고 LiF 치밀하고 안정적인 SEI층 형성에 도움을 줄 수 있습니다.
2.3 전기화학적 성능 분석 Li||LiFePO4 배터리
LiFePO4는 높은 장점을 가지고 있습니다. 용량, 긴 사이클 수명, 뛰어난 안전성 등이 주류를 이루고 있는 긍정적인 요소입니다. 전극 활물질. 이론적인 비용량은 170mAh·g-1이다. ~에 25일에는 Li|GCE-20|LiFePO4 배터리를 한 번에 200회 충방전했다. 0.2C(1C=0.67mA·cm-2)의 정전류. 그림 4(a, b)에 도시된 바와 같이, 첫 번째 사이클의 방전 비용량은 141.4 mAh·g-1입니다. 방전 200번째 랩의 비용량은 131.4mAh·g-1로, 용량 유지율은 131.4mAh·g-1이다. 비율은 92.95%에 도달하고 단일 회전 용량 감소는 0.04% 미만입니다. 그만큼 LiFePO4의 특성에 맞춰 플랫폼 전압이 안정적입니다. 배터리. 배터리 평가의 중요한 지표인 쿨롱 효율 사이클 안정성은 배터리 방전 용량과 충전 용량의 비율을 나타냅니다. 동일한 주기 동안의 용량. 첫 번째 사이클 쿨롱 효율은 Li|GCE-20|LiFePO4 배터리는 97.8%입니다. SEI 층의 형성으로 인해 첫 번째 사이클 방전 과정에서 비가역 용량의 일부는 발생하여 첫 번째 사이클 쿨롱 효율이 낮아집니다.
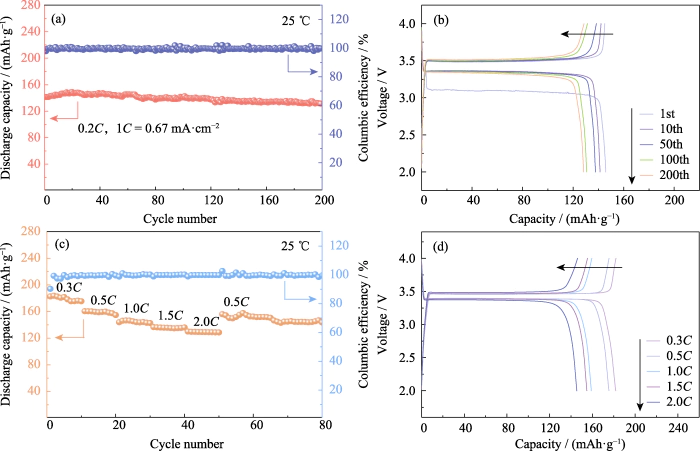
그림. 4 전기화학적 성능 Li|GCE-20|LiFePO4 셀
(a) 사이클링 성능 및 (b) 0.2C에서의 해당 전압-용량 곡선; (기음) 속도 성능 및 (d) 해당 전압-용량 곡선; 화려한 수치는 웹사이트에서 확인할 수 있습니다
이외에 충방전 시험 Li|GCE-20|LiFePO4에 대해 0.3C, 0.5C, 1C, 1.5C 및 0.5C 속도로 수행되었습니다. 현재의 속도 성능을 탐색합니다. 그림 4(c)에 도시된 바와 같이, 전류율은 0.5C이며, 첫 번째 사이클 방전 비용량은 배터리는 160.2mAh·g-1입니다. 전류율이 증가함에 따라 방전 특정 배터리 용량은 제어 가능한 범위 내에서 감소합니다. 요금은 2C로 증가하고 첫 번째 사이클의 비용량 d충전량은 130입니다 mAh·g-1. 이후 현재 환율은 다시 0.5C로 돌아왔고, 첫 번째 주기 방전의 비용량은 156.1 mAh·g-1이었습니다. 관련 전압-용량 곡선은 그림 4(d)에 나와 있습니다. 고원 전압 다른 속도는 과전압을 증가시키지 않고 안정적이며 배터리는 좋은 속도 성능과 가역성을 보여줍니다.
3 결론
PEGDA 기반 GCE는 열적으로 개발되었습니다. 현장 중합을 시작합니다. FT-IR 및 XRD 특성 분석 GCE와 전기화학적 테스트를 결합하여 최적의 GCE를 선별했습니다. 공식화. 전기 화학을 연구하기 위해 배터리를 추가로 조립하십시오. 전해질의 성능과 보호 효과를 분석합니다. 리튬 금속 음극의 전해질을 관찰하여 리튬 금속의 미세한 형태 및 표면 원소 특성 분석, 설명:
1) GCE-x (x=10, 20, 30) 현장 중합은 전극 시트를 잘 적실 수 있으며 전해질은 PEGDA의 질량분율이 20%일 때 전기화학적 안정성이 가장 좋다.
2) LiTFSI의 디리튬염 시스템 및 폴리머와 좋은 상호작용을 형성할 수 있는 LiDFOB가 도입되었습니다. 구성 요소. 전해질은 넓은 전기화학적 창(5.26V)과 높은 이온 전도성(30…, 1×10-3 S·cm-1). 동시에, 디리튬염 안정적인 SEI 레이어를 구축하고 효과적으로 보호하기 위해 시스템을 사용할 수 있습니다. 리튬 금속 음극
3) GCE-20을 사용하여 광고 매칭 LiFePO4 양극재, 조립된 전체 배터리는 안정적으로 충전할 수 있으며 용량 유지율로 0.2C 전류에서 200회 방전 92.95%로 양호한 레이트 퍼포먼스를 보인다.
요컨대 이 작품은 안전하고 GCE의 우수한 전기화학적 성능으로 효과적인 안전하고 안정적인 고에너지밀도 리튬 개발을 위한 솔루션 금속 배터리.
추가자료:
S1 배터리 준비과정
LiFePO4, Ketjen Black 및 PVDF는 목표 비율에 따라 N-메틸피롤리돈 용매를 첨가합니다. (N-메틸피롤리돈, NMP)을 완전히 교반하고 분산시켜 균일하고 점성 활물질 슬러리. 슬러리를 알루미늄 위에 긁어 코팅하였다. 플랫 코터로 호일을 덮은 다음 진공 오븐으로 옮겨 80°C에서 건조합니다. 12시간 동안. 전극 시트를 절단한 후 다시 건조시킨 후 보관소에 옮깁니다. 무수 및 무산소 글로브 박스
개스킷, 파편, 리튬 금속 시트 음극케이스 중앙에 순차적으로 배치하였고, 리튬 금속 시트의 두께는 0.35mm였다. 이어서, 전구체 GCE 용액을 네거티브 표면 중앙에 한 방울씩 첨가했습니다. 피펫 건을 사용하여 전극(50μL)을 사용한 다음 Celgard 2500 배터리를 사용합니다. 분리막 및 양극 시트(Celgard 2500 배터리 분리막) 차례대로 배치되었습니다. Li||LiFePO4 배터리를 조립하기 전에, 양극 조각의 무게를 측정하고 활성 물질 로딩을 기록했습니다. LiFePO4 양극의 활물질 표면 로딩량은 3.94였습니다. mg cm-2. 마지막으로 배터리 밀봉기에 배터리를 가압하여 밀봉하고, 70°C 환경으로 옮기고 2시간 동안 가열하여 시작합니다. 겔 상태 전해질을 얻기 위한 중합. 이를 보장하기 위해 전해질이 LiFePO4 극편에 완전히 침투하면 배터리를 조립 후 1시간 동안 방치.
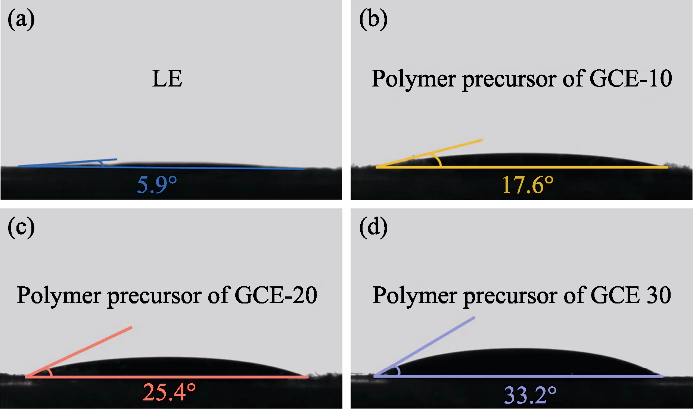
그림 S1 고분자 전구체 용액과 음극 사이의 접촉각
(a) LE; (b) GCE-10; (c) GCE-20; (라) GCE-30
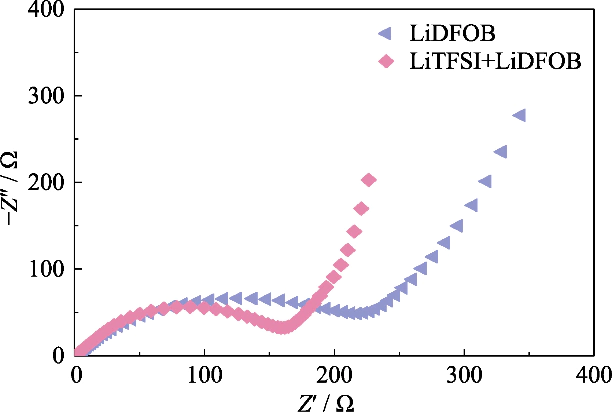
그림. S2 다양한 리튬 염을 사용하여 GCE 조립된 Li||LiFePO4 셀의 나이퀴스트 플롯
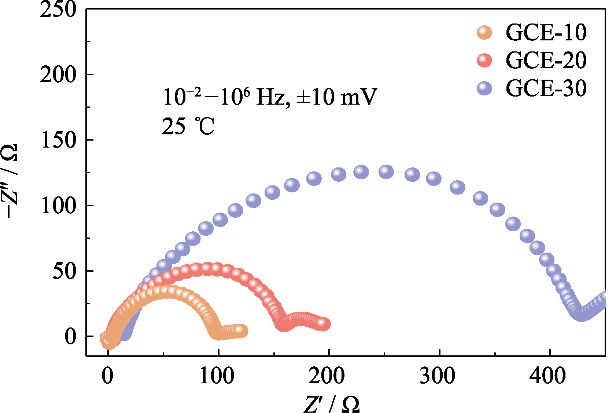
그림. GCE-x 전해질<349로 조립된 대칭 Li||Li 셀의 S3 나이퀴스트 플롯
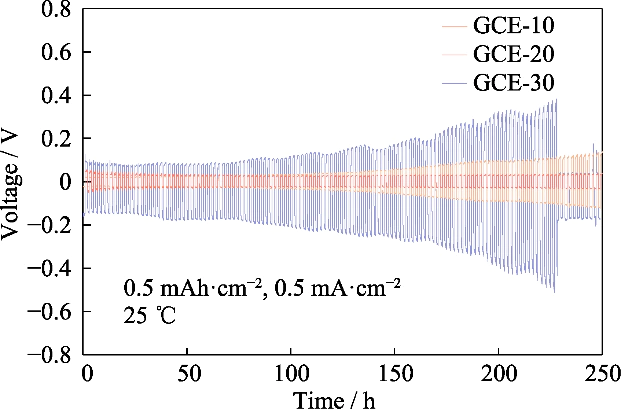
그림. S4 VGCE-x 전해질로 조립된 대칭 Li||Li 셀의 전압 시간 프로파일
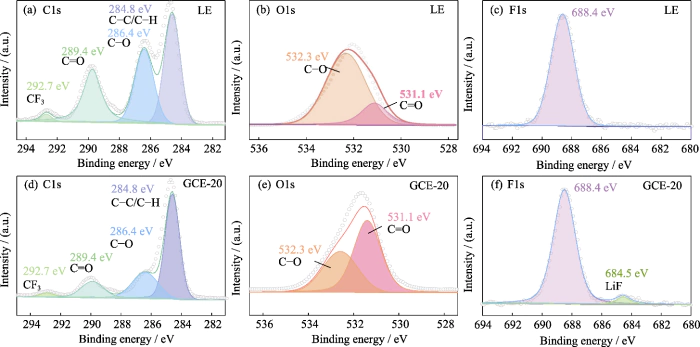
그림. S5 X대칭 Li||Li 셀에서 금속 Li 양극의 PS 스펙트럼
(a, d) C1s, (b, e) O1s, (c, f) (a-c) LE 및 (d-f) GCE-20을 포함하는 금속 Li 양극의 F1s XPS 스펙트럼
[1] 굿이너프 J B, 김 Y.
에 대한 도전 재충전가능한 리튬전지
화학 자료, 2010, 22(3):587.
[2] ZHAO J, LIAO L, SHI F 등 알.
표면 불소화 안정성 향상을 위한 반응성 전지 음극재
저널 미국화학회, 2017, 139(33):11550.
[3] TARASCON J M, ARMAND M.
문제와 과제 리튬 충전용 전지 를 향함
자연, 2001, 414(6861):359.
[4] ZHI J, YAZDI A Z, VALAPPIL G 등
인공고체 수성 리튬 에너지 저장 시스템용 전해질 간기
Science Advances, 2017, 3(9):e1701010.
[5] JUN K, SUN Y, XIAO Y, et al.
리튬 슈퍼이온 코너 공유 프레임워크가 있는 도체
Nature Materials, 2022, 21: 924.
[6] LIU J, BAO Z, CUI Y 등 al.
진로 실용적인 고에너지 장주기 리튬금속전지
네이처 에너지, 2019, 4(3):180.
[7] DUNN B, KAMATH H, TARASCON J M.
전기에너지 그리드를 위한 저장: 선택의 배터리
과학, 2011, 334(6058):928.
[8] MAUGER A, JULIEN C M, PAOLELLA A 등
더 나은 건물 고체 상태의 배터리: 리뷰
자료, 2019, 12(23):3892.
[9] 만티람 A, YU X, WANG S.
리튬 배터리 고체 전해질로 구현되는 화학
자연 리뷰 자료, 2017, 2(4):16103.
[10] ZHOU D, SHANMUKARAJ D, TKACHEVA A, et al.
고분자 전해질 리튬 기반 배터리의 발전과 전망
화학, 2019, 5(9):2326.
[11] 탄에스 J, YUE J, TIAN Y F 등
난연성 인산염을 견고한 폴리머 매트릭스로 현장 캡슐화 안전하고 안정적인 준고체 리튬금속전지
에너지 저장 자료, 2021, 39: 186.
[12] ZHAO Q, LIU X, STALIN S 등 al.
고체 중합체 2차 리튬을 위한 빠른 계면 수송 기능이 내장된 전해질 배터리
네이처 에너지, 2019, 4(5):365.
[13] ZHOU Z, FENG Y, WANG J 등 al.
견고하고 고도로 안정적인 리튬 금속 배터리를 위한 신축성 이온 전도성 스킨
화학공학과 저널, 2020, 396: 125254.
[14] WILKEN S, TRESKOW M, SCHEERS J 등 al.
초기 단계 상세한 라만 및 NMR을 이용한 LiPF6 기반 리튬 이온 배터리 전해질의 열분해 분광학
RSC Advances, 2013, 3(37):16359.
[15] 리우 F Q, WANG WP, YIN Y X 등
전통적인 업그레이드 미래 리튬을 위한 현장 겔화를 통한 액체 전해질 금속 배터리
Science Advances, 2018, 4(10):eaat5383.
[16] XU C, SUN B, GUSTAFSSON T, et al.
인터페이스 레이어 고체 고분자 전해질 리튬 배터리의 형성: XPS 연구
재료저널 화학 A, 2014, 2(20):7256.
[17] WEI Z, CHEN S, WANG J 등 al.
우수한 리튬 이온 무용매를 통한 빗 모양 구조의 고분자 전해질 전도 양극성 전고체 리튬전지 공중합
재료저널 화학 A, 2018, 6(27):13438.
[18] 디노토 V, LAVINA S, GIFFIN G A 등
고분자 전해질: 현재, 과거, 미래
Electrochimica Acta, 2011, 57(15):4.
[19] XUE Z, HE D, XIE X.
폴리(에틸렌 리튬이온전지용 산화물)계 전해질
재료저널 화학 A, 2015, 3(38):19218.
[20] MINDEMARK J, 레이시 M J, BOWDEN T, 외
그 너머에 Li+ 전도성 고체 고분자 전해질을 위한 PEO 대체 호스트 재료
폴리머의 발전 과학, 2018, 81: 114.
[21] ARAVINDAN V, GNANARAJ J, MADHAVI S 등 al.
리튬이온 리튬전지용 전해질염 전도
Chemistry-A European Journal, 2011, 17(51):14326.
[22] XU K.
전해질 및 리튬 이온 배터리 및 그 이상의 간기
화학 리뷰, 2014, 114(23):11503.
[23] 양H, ZHUANG G V, 로스 JR P N.
열안정성 LiPF6 염 및 리튬 이온 배터리 LiPF6를 함유한 전해질
힘의 저널 출처, 2006, 161(1):573.
[24] LI Q, LIU G, CHENG H 등 al.
저온 리튬이온전지용 전해질 설계: 전망과 과제
화학-A 유럽 저널, 2021, 27(64):15842.
[25] JIAO S, REN X, CAO R 등 al.
안정적인 사이클링 에테르 전해질의 고전압 리튬 금속 배터리
네이처 에너지, 2018, 3(9):739.
[26] LIU Y, YU P, SUN Q 등 al.
예측된 오페란도 붕소 삽입을 통한 리튬 양극에서의 중합
ACS 에너지 레터, 2021, 6(6):2320.
[27] CAO W, LU J, ZHOU K 등 al.
유무기 현장 중합에 의한 안정적인 Li 금속 양극용 복합 SEI
나노 에너지, 2022, 95: 106983.
[28] 쳉 S, 스미스 D M, LI C Y.
나노스케일은 어떻게 이루어지나요? 결정 구조가 고체 고분자 전해질의 이온 수송에 영향을 미치나요?
거대분자, 2014, 47(12):3978.
[29] 요한슨 P.
첫 번째 원칙 비정질 고분자 전해질 모델링: Li+-PEO, Li+-PEI 및 Li+-PES 복합체
폴리머, 2001, 42(9):4367.
[30] SUN B, MINDEMARK J, EDSTRÃM K, et al.
폴리카보네이트 기반 리튬 이온 배터리용 고체 고분자 전해질
Solid State Ionics, 2014, 262: 738.
[31] 실바M M, BARROS S C, SMITH M J 등
의 특성화 폴리(트리메틸렌카보네이트) 및 리튬 기반 고체 고분자 전해질 테트라플루오로보레이트
Electrochimica Acta, 2004, 49(12): 1887.
[32] 바르보사 P, 로드리게스 L, 실바 M 금속.
의 특성화 pTMCnLiPF6 고체 고분자 전해질
Solid State Ionics, 2011, 193(1):39.