Na3Zr2Si2PO12세라믹 Na-이온 전지용 전해질: 분무건조법을 이용한 제조 및 그 방법 속성
저자: LI Wenkai, ZHAO Ning, BI Zhijie, GUO Xiangxin. Na3Zr2Si2PO12 Na 이온 배터리용 세라믹 전해질: 다음을 사용한 준비 분무건조방법 및 그 특성. 무기재료저널, 2022, 37(2): 189-196 DOI:10.15541/jim20210486
초록
현재 가연성 및 폭발성 유기물을 사용하는 Na 이온 배터리 전해질, 이제 고성능 나트륨이온 고체 개발이 시급하다 보다 안전하고 실용적인 적용을 실현하는 전해액입니다. Na3Zr2Si2PO12는 다음 중 하나입니다. 넓은 전기화학적 창을 통해 가장 유망한 고체 나트륨 전해질, 높은 기계적 강도, 우수한 공기 안정성 및 높은 이온 전도성. 그러나 세라믹 입자와 바인더의 불균질한 혼합으로 인해 성형체에 기공이 너무 많아 고밀도를 얻기가 어렵습니다. 및 소결 후 고전도성 세라믹 전해질. 여기서 스프레이는 Na3Zr2Si2PO12 입자를 활성화하기 위해 건조 방법이 사용되었습니다. 바인더로 균일하게 코팅하고 구형의 2차로 과립화합니다. 그만큼 준비된 정규 분포 입자는 효과적으로 서로 접촉할 수 있으며 세라믹 그린 바디의 다공성을 줄입니다. 소결 후 Na3Zr2Si2PO12 세라믹 분무 건조를 통한 펠렛의 상대 밀도는 97.5%입니다. 실내 이온 전도도는 6.96×10-4 S×cm-1입니다. 온도. 대조적으로, 상대밀도와 실온 Na3Zr2Si2PO12 세라믹 펠렛의 이온 전도도 분무 건조 없이 제조된 제품은 각각 88.1% 및 4.94×10-4 S…cm-1에 불과합니다.
키워드 Ⅰ¼ 고체전해질; 분무건조법; 밀도; 이온 전도도; Na3Zr2Si2PO12
나트륨 이온과 리튬 이온은 모두 다음에 속합니다. 첫 번째 주요 그룹은 유사한 화학적 특성과 층간 삽입을 가지고 있습니다. 메커니즘이 풍부하고 자원 보유량이 풍부합니다. 그래서 나트륨이온전지는 리튬 이온 배터리를 보완할 수 있습니다[1, 2, 3]. 다음을 포함하는 나트륨 이온 배터리 가연성, 휘발성 유기 전해질은 안전 문제를 야기하며 제한적입니다. 에너지 밀도. 액체전해질 대신 고체전해질을 사용하는 경우 안전 문제가 해결될 것으로 예상된다[4,5,6,7,8]. 무기고체전해질 넓은 전기화학적 창을 가지며 고전압 음극과 일치할 수 있음 재료를 사용하여 배터리의 에너지 밀도를 높입니다[9]. 하지만, 고체 전해질은 낮은 이온 전도도와 어려운 문제에 직면해 있습니다. 전극과 전해질 사이의 경계면에서 이온 전달. 하는 동안 인터페이스를 최적화하려면 먼저 고체 전해질을 찾는 것이 필요합니다. 높은 이온 전도성 [10, 11, 12].
현재 가장 많이 연구되고 있는 나트륨이온은 무기 고체 전해질에는 주로 Na-β”-Al2O3, NASICON 유형 및 황화물. 그 중 NASICON(Sodium Super Ion Conductors)형 고속이온은 도체는 고체 나트륨 이온 배터리 응용 분야에서 큰 잠재력을 가지고 있습니다. 넓은 전기화학적 창, 높은 기계적 강도, 안정성으로 인해 공기에, 그리고 높은 이온 전도도 [13,14] . 원래는 다음 사람이 보고했습니다. Goodenough 및 Hong et al. [15,16]. 일반식은 Na1+xZr2SixP3-xO12입니다. (0...x...3)은 NaZr2(PO4)3와 Na4Zr2(SiO4)3은 개방형 3차원 Na+ 전송 채널을 가지고 있습니다. Na1+xZr2SixP3-xO12에는 마름모 구조(R-3c)와 단사정계의 두 가지 구조가 있습니다. 구조(C2/c, 1.8…x…2.2). x=2일 때 Na3Zr2Si2PO12는 가장 높은 이온성을 갖습니다. 전도도. 300…에서 Na3Zr2Si2PO12의 이온 전도도는 0.2 S…cm-1에 도달할 수 있으며 이는 Na-β…-Al2O3(0.1~ 0.3 S...cm-1) [15]. 현재 실온 이온 문헌[17,18]에 보고된 Na3Zr2Si2PO12의 전도도는 다음과 같습니다. 대략 ~10-4 Sâcm-1. 원소 도핑 이온 전도도를 향상시키기 위해 일반적으로 사용되는 방법이 있습니다. NASICON 솔리드 이후 전해질은 개방형 골격 구조를 갖고 있어 다양한 물질로 도핑될 수 있습니다. 강요. 예를 들어 Zr4+를 대체하는 원소로는 Mg2+, Zn2+, Al3+, Sc3+, Y3+, La3+, Ti4+, Hf 4+, Nb5+, Ta5+ 등 [17, 18, 19, 20, 21, 22]. 저것들 P5+ 대체에는 Ge5+ 및 As5+가 포함됩니다[22]. 원소 도핑 외에도 Na3Zr2Si2PO12 세라믹 시트의 밀도를 높이는 것도 일반적인 방법입니다. 이온 전도도를 향상시키기 위해. 최근에는 Yang et al. [18] 사용된 요소 산소분위기에서 도핑과 소결을 결합하여 고도로 합성 밀도가 높은 Na3.2+2xZr2-x ZnxSi2.2P0.8O12(0…x…0.15). x=0.1일 때 방 온도 이온 전도도는 최대값(5.27Ã10-3 Sâcm-1)에 도달합니다. Na3Zr2Si2PO12 세라믹 전해질의 제조방법 포함: 기존 소결(CS), 액상 소결(LPS), 스파크 플라즈마 소결(SPS), 마이크로파 소결(MWS), 냉간 소결 공정 (CSP) [18-21,23-29]. 그 중에는 Huang et al. [20] 기존 소결법을 사용함 Ga3+를 도핑하여 세라믹의 밀도를 높이는 방법. 세라믹 더 높은 실내 온도 이온 전도도(1.06×10-3 S…cm-1)와 낮은 전자 전도도(6.17×10-8 S…cm-1)를 가진 전해질을 얻었습니다. ZHANGet al. [21] 기존 소결 방식을 채택 양이온 La3+을 도입하는 방법. 중간상 Na3La(PO4)2가 형성됩니다. 결정립계에는 Na3.3Zr1.7La0.3Si2PO12 세라믹 시트가 있으며, 99.6%의 높은 밀도가 얻어집니다. 해당 실온 이온 전도도는 3.4Ã10-3 Sâcm-1에 도달할 수 있습니다. 왕 외. [23] 사용됨 고밀도 Na3Zr2Si2PO12 세라믹을 얻기 위한 마이크로파 소결(MWS) 850°C의 낮은 소결 온도에서 96%, 0.5시간 동안만 유지되어 소결 감소 소송 비용. 상대 밀도(rrelative), 이온 전도도(Ït) 및 다양한 방법으로 제조된 세라믹 전해질의 활성화 에너지(Ea) <표 1과 같다.
표 1 NASICON 유형의 주요 매개변수 다양한 소결방법을 위한 재료
|
소결방법 |
구성 |
소결 |
소결 |
시간/시간 |
상대/% |
st/(S...cm-1) |
Ea/eV |
참고 |
|
CSP |
Na3.256Mg0.128Zr1.872Si2PO12 |
140 |
없음 |
1 |
82.9 |
0.41Â'10-4 |
- |
[19] |
|
FH-CSP |
Na3Zr2Si2PO12 |
375 |
수산화나트륨 |
3 |
93 |
2.2Â'10-4 |
0.32 |
[24] |
|
LPS |
Na3Zr2Si2PO12 |
1150 |
NaF |
24 |
- |
1.7Â'10-3 |
0.28 |
[25] |
|
LPS |
Na3Zr2Si2PO12 |
900 |
Na3BO3 |
10 |
93 |
1.4Â'10-3 |
- |
[26] |
|
LPS |
Na3Zr2Si2PO12 |
1175 |
Na3SiO3 |
10 |
93 |
1.45Â'10-3 |
- |
[27] |
|
SPS |
Na3.4Zr1.6Sc0.4Si2PO12 |
1100 |
코하크 |
0.1 |
95 |
9.3Â'10-4 |
- |
[28] |
|
SPS |
Na3Zr2Si2PO12 |
1210 |
없음 |
0.5 |
97.0 |
1.7Â'10-3 |
0.28 |
[29] |
|
MWS |
Na3Zr2Si2PO12 |
850 |
없음 |
0.5 |
96 |
2.5Â'10-4 |
0.31 |
[23] |
|
CS |
Na3Zr2Si2PO12 |
1250 |
없음 |
16 |
71.4 |
1.7Â'10-4 |
0.36 |
[20] |
|
CS |
Na3.1Zr1.9Ga0.1Si2PO12 |
1250 |
없음 |
16 |
86.5 |
1.06Â'10-3 |
0.29 |
[20] |
|
CS |
Na3Zr2Si2PO12 |
1200 |
없음 |
24 |
87.6 |
6.7Â'10-4 |
0.353 |
[21] |
|
CS |
Na3.3Zr1.7La0.3Si2PO12 |
1200 |
없음 |
24 |
99.6 |
3.4Â'10-3 |
0.291 |
[21] |
|
CS |
Na3Zr2Si2PO12 |
1250 |
없음 |
- |
84.02 |
2.17Â'10-4 |
0.407 |
[18] |
|
O2-CS |
Na3.4Zr1.9Zn0.1Si2.2P0.8O12 |
1250 |
없음 |
- |
99.46 |
5.27Â'10-3 |
0.285 |
[18] |
|
CS |
Na3Zr2Si2PO12 |
1250 |
없음 |
6 |
88.1 |
4.94Â'10-4 |
0.34 |
이 작품 |
|
SD-CS |
Na3Zr2Si2PO12 |
1250 |
없음 |
6 |
97.5 |
6.96Â'10-4 |
0.32 |
이 작품 |
CS: 통상적인 소결; SD: 분무 건조; O2-CS: 순수 재래식 소결 산소; CSP: 냉간 소결 공정; FH-CSP: 용융수산화물 냉소결 프로세스; MWS: 마이크로파 소결; LPS: 액상 소결; SPS: 스파크 플라즈마 소결
기존의 방법은 다음과 같이 제조된 분말을 사용합니다. 직접 소결하여 바인더와 혼합하여 세라믹 본체 분말을 제조한 후 분말 성형 및 고온 소결을 거쳐 세라믹을 얻는다 [30, 31, 32]. 그러나 분쇄 및 혼합과정에서 혼합이 고르지 못하여 바인더와 세라믹 입자의 결합이 불량하고 입자간의 접촉이 불량한 경우가 있습니다. 그린바디 내부에 기공이 많아 세라믹 제작이 어렵습니다. 밀도가 높고 이온 전도도가 높은 전해질. 분무건조는 분무기를 사용하여 슬러리를 물방울로 분산시키는 급속 건조 방식 뜨거운 공기를 사용하여 물방울을 건조시켜 분말을 얻습니다. 입자는 분무건조로 제조된 분말은 구형이며 바인더가 고르게 분포될 수 있습니다. 입자 표면에 코팅되어 있다[33]. KOUet al. [34] 분무건조를 이용함 고온 소결과 결합하여 고체 전해질을 합성 Li1.3Al0.3Ti1.7SixP5(3-0.8x)O12 (LATSP), 높은 실온 이온성 전도도. x=0.05일 때, 실온 이온 전도도는 최대 1.053Ã10-4 Sâcm-1 및 압축 밀도는 2.892g∙cm-3으로 이론 밀도에 가깝습니다. 2.94g∙cm-3의 LATSP. 분무건조하는 것을 볼 수 있다. 세라믹의 밀도와 이온 전도도를 향상시키는 데 있어 특정 이점 전해질. 분무 건조의 장점을 고려하여 요소의 효과 세라믹 밀도와 이온 전도도에 대한 도핑을 고려해야 합니다. 이것 연구대상으로 Na3Zr2Si2PO12를 선정하고 스프레이를 도입하였습니다. 분말 재료의 예비 준비에 과립화 방법을 추가합니다. 밀도가 높고 이온성이 높은 Na3Zr2Si2PO12 세라믹 전해질 제조 전도성.
1 실험방법
1.1 재료 준비
Na3Zr2Si2PO12분말의 제조방법: Na2CO3(알라딘, 99.99%), NH4H2PO4(알라딘, 99%), ZrO2(알라딘, 화학량론적 비율에 따르면 99.99%), SiO2(Aladdin, 99.99%)입니다. ~ 안에 소결 중 Na 및 P의 휘발을 보상하기 위해 공정에서 원료에는 8% 초과의 Na2CO3 및 15% 초과의 NH4H2PO4 [25]. 볼밀링 매체로는 지르코니아 볼을 사용하였고, 재료/볼 중량 비율은 1:3이었고, 분산액으로 무수 에탄올을 사용했습니다. 중간, 볼밀은 12시간 동안 볼밀링에 사용되었습니다. 볼밀링된 슬러리를 80℃ 오븐에서 12시간 동안 건조시켰다. 건조된 분말을 분쇄하고, 150메시(100μm) 체를 통과한 후 400°C로 옮겼습니다. 2시간 동안 알루미나 도가니. 전구체에서 CO32- 및 NH4+를 제거한 후 가열합니다. 하소를 위해 1000~1150°C까지 가열하고 12시간 후에 어닐링하여 얻습니다. Na3Zr2Si2PO12 분말.
Na3Zr2Si2PO12 세라믹의 제조방법 시트: Na3Zr2Si2PO12 입자 크기가 표면에 미치는 영향을 조사하기 위해 세라믹 시트의 밀도에 따라 두 세트의 제어 실험이 설계되었습니다. 그만큼 첫 번째 그룹은 기존 방법을 사용하여 2%(질량 분율) 폴리비닐을 첨가했습니다. 순수상 Na3Zr2Si2PO12 분말에 알코올(알라딘, Mw~205000) 결합제를 첨가 무수 에탄올 및 12시간 동안 볼 밀링. 볼밀링 후의 분말은 건조, 분쇄 및 체질하여 입자에 결합제가 코팅된 분말을 얻습니다. 표면. 분말은 스테인리스를 사용하여 200 MPa에서 일축 냉간 압착됩니다. GB로 기록된 Ï12 mm의 녹색 몸체를 만들기 위한 강철 주형. . 줄이기 위해 세라믹 시트의 소결 과정에서 Na와 P의 휘발, 그린 바디를 모분말에 묻혀 1250°C에서 6분간 소결했습니다. 몇 시간 동안 가열한 후 4°C/min의 가열 속도로 어닐링했습니다. 얻은 Na3Zr2Si2PO12 세라믹 전해질은 CS-NZSP로 지정되었습니다. 두 번째 그룹 Na3Zr2Si2PO12 분말을 과립화하기 위해 분무 건조기(ADL311S, Yamato, Japan)를 사용했습니다. 2%(질량 분율) 폴리비닐 알코올(알라딘, Mw ~205000) 바인더와 2%를 추가합니다. Na3Zr2Si2PO12 분말에 폴리에틸렌 글리콜(알라딘, Mn=1000) 분산제, 그리고 무수 에탄올을 첨가합니다. 질량 15%의 고형분을 함유한 현탁액을 준비합니다. 12시간 동안 분획 및 볼밀을 수행합니다. 볼밀링된 현탁액을 분무 건조했습니다. 입구 온도는 130°C이고 공급 유량은 5mL/분입니다. 그만큼 Na3Zr2Si2PO12 분말은 사이클론 분리기를 통해 수집되었습니다. 정제 세라믹 소결 공정은 첫 번째 그룹과 동일하며, 얻은 Na3Zr2Si2PO12 녹색체와 세라믹 전해질은 다음과 같이 기록되었습니다. 각각 SD-GB 및 SD-CS-NZSP. 세라믹 표면연마처리 타일: 먼저 거친 연마를 위해 400메시(38μm) 샌딩 페이퍼를 사용한 다음 1200메시(2.1μm) 샌딩 페이퍼를 사용하여 세라믹이 완전히 연마될 때까지 미세 연마합니다. 표면이 매끄 럽습니다. CS-NZSP 및 SD-CS-NZSP 세라믹 전해질의 직경 시트는 각각 (11.3±0.1) 및 (10.3±0.1)mm이고 두께는 (1.0±0.1)mm.
1.2 재료의 물리적 특성
샘플의 상분석은 다음과 같다. X선 회절계(XRD, Bruker, D8 Advance)를 사용하여 수행되었습니다. 그만큼 방사선 소스는 CuKα, 튜브 압력은 40kV, 튜브 흐름은 40mA, 스캐닝 속도는 2(°)/min이고 스캐닝 범위는 2θ= 10°~80°입니다. 스캐닝 전자현미경(SEM, Hitachi, S-4800) 및 투과전자현미경 (TEM, JEOL, JEM-2100F)을 이용하여 시료의 형태를 분석하였고, 구성된 EDX 액세서리가 원소 분석에 사용되었습니다.
1.3 전기전도도 측정 세라믹 시트
전기화학적 임피던스 분광법 (EIS) 샘플은 전기화학적 워크스테이션을 사용하여 테스트되었습니다. 테스트 주파수 범위는 7MHz~0.1Hz, 인가 전압은 10mV, 테스트 곡선 장착하고 세라믹 조각의 이온 전도도는 다음을 사용하여 계산됩니다. 식(1).
Ï=L/(RÃS) (1)
공식에서 L은 두께입니다. 세라믹 시트(cm), R은 저항(Ω), S는 차단 전극 면적 (cm2)이고 Ï는 이온 전도도(S...cm-1)입니다.
시료의 전자전도도 5의 정전압으로 직류 분극(DC)을 사용하여 테스트되었습니다. V 및 지속 시간은 5000초입니다. 곡선이 안정된 후의 세로좌표 값 분극 전류 값입니다. 공식 (2, 3)을 사용하여 세라믹 시트의 전자전도도 및 나트륨이온 이동수.
Ïe=LÃI/(VÃS) (2)
t=(Ï-Ïe)/Ï (3)
공식에서 L은 두께입니다. 세라믹 시트(cm), I는 분극 전류(A), V는 전압(V), S 는 차단 전극 면적(cm2)이고 Ïe는 전자 전도도(S...cm-1)입니다. 이 연구에서는 Au를 차단 전극으로 사용합니다. 준비 차단 전극 : 고진공 저항 증발 코팅 장비 사용 (VZZ-300) 저항가열을 통해 증발원 Au를 증발시키고, 세라믹 시트 표면에 증발시킵니다. 세라믹 시트는 내경 8mm의 페룰에 고정됩니다.
2 결과 및 논의
2.1 상의 구조와 형태 Na3Zr2Si2PO12의 특성 분석
소결을 최적화하기 위해 Na3Zr2Si2PO12의 온도에서 분말은 1000, 1050, 1100에서 소결되었으며 각각 1150… 얻은 샘플의 X선 회절 패턴 다른 온도에서 소결하는 과정은 그림 1에 나와 있습니다. 볼 수 있습니다. 그림에서 소결 온도가 1000°C일 때 주상은 Na3Zr2Si2PO12가 생성되었으나 Na2ZrSi2O7 및 ZrO2 불순물이 있음 위상 및 주요 위상의 회절 피크 강도가 약하고 반피크 폭이 넓어 소결 제품의 품질이 좋지 않음을 나타냅니다. 결정 성. 소결온도가 1100℃일 때 ZrO2 불순물은 상이 사라지고 Na2ZrSi2O7 불순물의 회절 피크 강도 상이 약해지며 이는 소결 온도가 증가한다는 것을 나타냅니다. 불순물 단계를 제거하는 데 도움이 됩니다. 회절 피크는 1100 및 1150°C에서 소결된 제품은 일반 제품보다 반 피크 폭이 더 작습니다. 1000°C에서 소결된 제품의 회절 피크는 소결 온도가 높을수록 제품의 결정성이 좋아집니다. 1000… 소결제품과 비교하면 1150… 소결품은 2θ = 19.2°, 27.5°, 30.5°로 분할됩니다. 이는 다음을 보여줍니다. 물질은 이온 전도도가 낮은 마름모상에서 마름모상으로 변화합니다. 높은 이온 전도도를 갖는 단사정계 [25,35]. 그리고 회절 피크 표준 PDF 84-1200 회절 피크와 일치하며 이는 1150°C는 Na3Zr2Si2PO12 고체 전해질의 상 형성 온도입니다. 이온전도도가 높은 단사정계 구조를 가지고 있습니다.
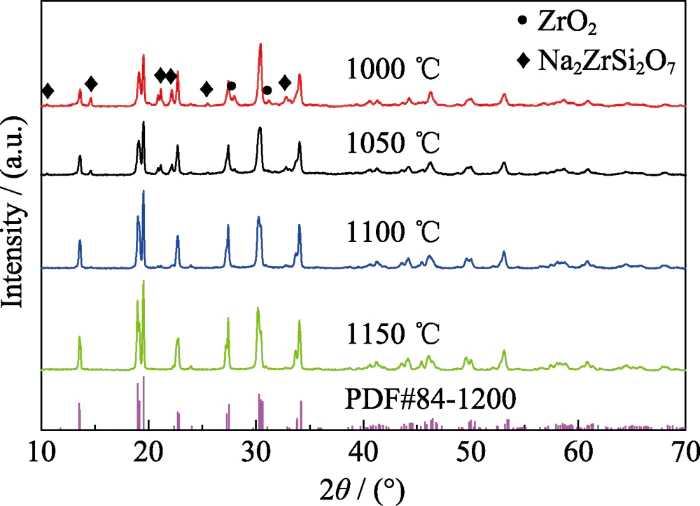
그림. 1 XRD Na3Zr2Si2PO12 분말 소결 패턴 다른 온도에서
그림 2는 SEM 사진과 TEM 사진을 보여줍니다. 기존 혼합 및 분무 건조로 얻은 Na3Zr2Si2PO12 입자 행동 양식. 그림 2(a)는 Na3Zr2Si2PO12 입자의 SEM 사진이다. 기존의 혼합. 사진을 보면 모양이 알 수 있듯이 입자는 불규칙하며 일부 입자의 직경은 20μm에 이릅니다. 이는 기존의 혼합 후 입자의 크기가 크고 모양이 고르지 않음. 그림 2(b~c)는 Na3Zr2Si2PO12 입자의 SEM 사진을 보여준다. 분무 건조 후. 입자는 구형이고 입자 직경은 5 μm 미만으로 입자 모양이 규칙적이며 입자가 분무 건조 후에는 크기 분포가 더 집중됩니다. 그림 2(d)는 TEM이다. 분무 건조 후 Na3Zr2Si2PO12 입자 표면 사진. 그만큼 입자 표면은 두께의 바인더 층으로 균일하게 코팅됩니다. 약 5nm로 세라믹 입자 사이의 밀착에 도움이 됩니다.

그림 2 기존 Na3Zr2Si2PO12 입자의 SEM 이미지 혼합(a) 및 분무 건조(b-c) 및 분무 후 Na3Zr2Si2PO12 입자 표면의 TEM 이미지(d) 건조
그림 3은 입자 크기를 보여줍니다. 폴리비닐알코올 코팅 Na3Zr2Si2PO12(NZSP)의 분포도 일반적인 혼합과 폴리비닐알코올 코팅된 Na3Zr2Si2PO12로 얻은 분무건조법으로 얻은 (SD-NZSP). 다음과 같은 것을 알 수 있다. SD-NZSP 입자 크기 분포 곡선의 반피크 폭이 더 좁습니다. NZSP 입자 크기 곡선보다 입자 크기가 분무 건조 후 분포가 더욱 집중됩니다. 이는 기본적으로 그림 2(a,b)의 SEM 사진에 표시된 결과와 일치합니다. ~ 안에 또한, 분무건조 후의 입자 크기 분포 곡선은 정규 분포. 이 입자 크기 그라데이션은 효과적으로 증가할 수 있습니다. 입자 사이의 접촉을 줄이고 녹색 몸체의 다공성을 줄입니다. 표시된 바와 같이 표 2에서, 기존 혼합 방식은 83.01%이고 Na3Zr2Si2PO12의 밀도는 분무건조법으로 제조된 생지의 함량이 89.12%로 증가하였습니다. 순서대로 Na3Zr2Si2PO12 입자 크기가 세라믹 밀도에 미치는 영향을 추가로 조사합니다. 전도도, 단면 스캐닝, 밀도 측정 및 전도성 테스트는 다음과 같이 얻은 Na3Zr2Si2PO12 세라믹 시트에 대해 수행되었습니다. 전통적인 혼합 및 분무 건조 방법.
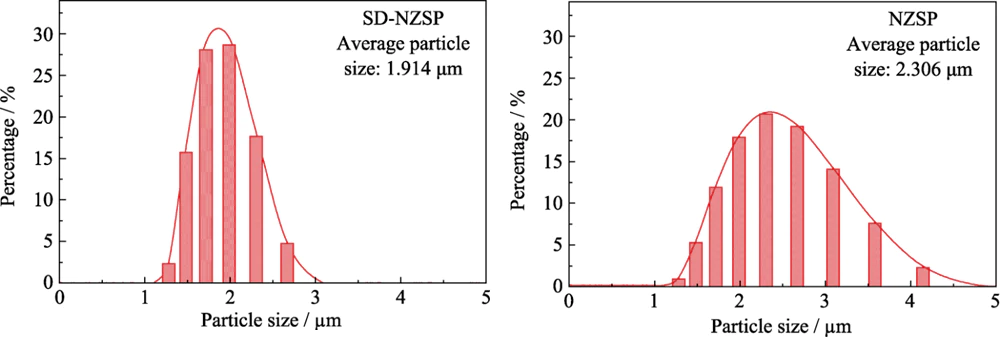
그림. 3 Na3Zr2Si2PO12 입자 크기 기존 혼합(NZSP) 및 분무 건조(SD-NZSP) 프로필 측정 레이저 입자 분석기로
표 2 소결 매개변수 및 밀도 측정 매개변수 Na3Zr2Si2PO12 고체 전해질 측정 결과 그린 바디 및 세라믹 시트
|
샘플 |
공정온도/... |
시간/시간 |
m/g |
메탄올/(g·cm-3) |
m수중/g |
rreal/(g·cm-3) |
이론적/(g·cm-3) |
상대/% |
|
GB |
- |
- |
0.2902 |
0.785 |
0.2056 |
2.693 |
3.244 |
83.01 |
|
SD-GB |
- |
- |
0.2880 |
0.785 |
0.2098 |
2.891 |
3.244 |
89.12 |
|
CS-NZSP |
1250 |
6 |
0.2672 |
0.785 |
0.1938 |
2.858 |
3.244 |
88.10 |
|
SD-CS-NZSP |
1250 |
6 |
0.2644 |
0.785 |
0.1988 |
3.164 |
3.244 |
97.53 |
그림 4는 실제 그림을 보여줍니다. Na3Zr2Si2PO12 세라믹 시트, 단면 형태 및 원소 분석 다이어그램. 그림 4 (a)는 단면 형태를 보여줍니다. 전통적인 소결 방법으로 얻은 세라믹 조각. 관찰되었다 세라믹 시트의 단면에 불규칙한 기공이 많이 존재한다는 점, 그리고 국소 기공 직경은 5 μm를 초과했습니다. 그 이유는 입자 크기 때문이다. 분쇄 후 고르지 않고 입자가 더 크고 닫히지 않습니다. 입자 사이의 접촉으로 인해 세라믹에 더 불규칙한 기공이 발생합니다. 2차 소결 공정 중 시트. 그림 4(b)는 분무건조로 얻은 세라믹 조각의 단면 형태 방법. 결정립들이 서로 밀접하게 접촉되어 있으며, 뚜렷한 모공이 없습니다. 이는 Na3Zr2Si2PO12 입자가 규칙적인 모양을 가지고 있음을 보여줍니다. 집중된 입자 크기 분포로 쉽게 고밀도를 얻을 수 있습니다. 2차 소결 공정 중 세라믹 시트. 밀도 증가 이는 이후 세라믹 본체의 수축 증가에도 반영됩니다. 그림 4(c)에 표시된 대로 소결됩니다. 왼쪽은 에서 얻은 세라믹 조각입니다. 기존 소결 방식으로 직경 11.34mm, 수축률 고작 5.5%의 비율; 오른쪽은 분무건조로 얻은 세라믹 조각입니다. 직경 10.36mm, 수축률 13.7%의 공법으로 제작되었습니다. 하기 위해 샘플의 각 원소의 조성을 탐색하고, 원소 분석을 실시했습니다. 세라믹 조각의 단면(그림 4(b))에서 수행되었으며 그림 4(d~g)를 얻었다. 각 요소의 내용은 표 3과 같다. 요소는 세라믹 조각의 단면에 고르게 분포되어 있습니다. 요소 집합이 없습니다. 표 3에 따르면, Na와 P의 원자 비율은 2.98:1이며 이는 기본적으로 다음과 일치합니다. 표준 화학식은 Na:P=3:1이며, 이는 Na 및 P가 과잉임을 나타냅니다. 원료는 Na와 P의 휘발을 보상할 수 있습니다. 소결 공정

그림. 4 CS-NZSP(a) 및 SD-CS-NZSP(b), 해당 사진(c) 및 원소 매핑 이미지 SD-CS-NZSP의 (d-g)
표 3 스프레이에 의한 Na3Zr2Si2PO12 세라믹 슬라이스 단면의 원소 분석 건조/%
|
요소 |
알겠습니다 |
나K |
시케이 |
피케이 |
ZrL |
|
원자 백분율 |
60.10 |
15.09 |
9.94 |
5.06 |
9.81 |
|
중량% |
36.43 |
13.13 |
10.59 |
5.94 |
33.91 |
2.2 Na3Zr2Si2PO12 세라믹 시트의 밀도
실험에서는 밀도를 측정했습니다. 아르키메데스의 방법을 통한 Na3Zr2Si2PO12 세라믹 시트 [30]. 공부하기 위해서는 Na3Zr2Si2PO12 세라믹의 밀도에 대한 과립화 방법의 영향 시트는 세라믹 시트 준비의 실험 매개변수에서 실험 변수(소결 온도, 유지 시간 등) 대조군 실험군은 과립화 방법을 제외하고 동일하게 유지하였다. ~ 안에 밀도에 대한 실험적 측정 오류의 영향을 줄이기 위해 결과적으로 세라믹 시트 샘플에 대해 밀도 측정을 반복했습니다. 실험에서 각 준비방법에 따라 얻은 결과이다. 실험에서 표 4에 표시된 데이터를 보면 CS-NZSP 세라믹의 밀도가 기존의 소결방식으로 얻은 시트는 88.1%로 기본적으로 문헌[21]에 보고된 결과와 일치한다. 밀도 분무 건조로 얻은 SD-CS-NZSP 세라믹 시트는 97.5%에 도달할 수 있습니다. 현재 기존 소결 방법으로 얻을 수 있는 가장 높은 가치입니다. 요소 도핑. Na3Zr2Si2PO12 세라믹의 밀도보다 훨씬 높습니다. 문헌에 보고된 다른 소결 방법으로 얻은 시트. 와 같은 마이크로파 소결법(96%)[23], 냉간소결법(93%)[24], 액상 상소결법(93%)[26], 방전플라스마 소결법(97.0%) [29].
표 4 CS-NZSP의 이온 전도도 및 실온에서 SD-CS-NZSP
|
샘플 |
sb/(S·cm-1) |
sgb/(S·cm-1) |
st/(S·cm-1) |
Ea/eV |
|
CS-NZSP |
1.28ø10-3 |
8.03ø10-4 |
4.94ø10-4 |
0.34 |
|
SD-CS-NZSP |
1.64ø10-3 |
1.21Ã10-3 |
6.96ø10-4 |
0.32 |
2.3 Na3Zr2Si2PO12 전기적 성능 테스트
그림 5(a)는 실내 온도를 보여줍니다. 에 의해 얻은 세라믹 웨이퍼의 전기화학적 임피던스 스펙트럼(EIS) 전통적인 소결법과 분무건조법이 있다. 의 반원은 그림은 결정립계의 병렬 임피던스 특성을 반영합니다. 임피던스와 용량성 리액턴스. 왼편의 교차점 반원과 가로좌표는 입자의 저항을 나타냅니다. 그만큼 가로좌표의 반원 범위는 곡물의 저항을 반영합니다. 경계, 그리고 반원 뒤의 사선은 임피던스를 반영합니다. 차단 전극/전해질 계면의 특성 [36] 에 의해 그림 4의 EIS를 피팅하면 CS-NZSP 및 SD-CS-NZSP의 이온 전도도 얻을 수 있습니다. 실험 데이터는 표 4에 나와 있습니다. 분무건조로 얻은 SD-CS-NZSP의 온도 이온 전도도 방법은 6.96×10-4 S×cm-1이며 이는 보다 높습니다. CS-NZSP(4.94×10-4) S...cm-1)은 기존의 소결 방법으로 얻은 것입니다. 통해 EIS 피팅의 데이터 분석을 통해 SD-CS-NZSP가 더 높은 것을 알 수 있습니다. 밀도는 입자 경계 저항이 더 작고 실온 이온이 더 높습니다. 전도성.
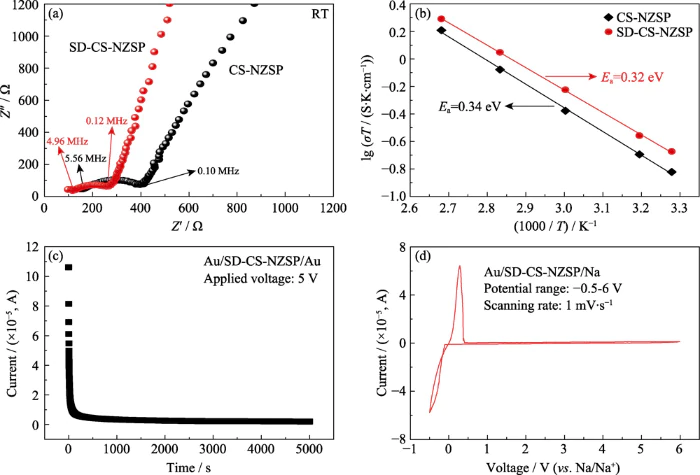
그림. 5 (a) 실온에서의 EIS 스펙트럼 및 (b) CS-NZSP 및 SD-CS-NZSP의 Arrhenius 플롯; (c) DC 정전위 분극 SD-CS-NZSP에 대한 전류 및 (d) 전기화학적 창
그림 5(b)는 Arrhenius 곡선을 보여줍니다. 다양한 준비로 얻은 세라믹 시트의 경우 실온 ~ 100°C 행동 양식. 그림에서 전도성이 증가함을 알 수 있습니다. 온도가 상승합니다. 온도가 100°C에 도달하면 전도성이 SD-CS-NZSP의 순서는 5.24Ã10-3 Sâcm-1에 도달할 수 있습니다. 실온 전도도보다 크기가 더 높습니다. 활성화 에너지 Arrhenius 방정식 Ï=Aexp(-Ea/kT)[7]에 따라 적합합니다. 활성화 에너지 CS-NZSP와 SD-CS-NZSP는 각각 0.34와 0.32eV로 얻어졌으며, YANG et al.의 보고와 유사하다. [18].
고체 전해질 재료는 높은 이온 전도도와 낮은 전자 전도도를 모두 갖습니다. 그러므로, SD-CS-NZSP의 전자 전도도는 직류로 측정되었습니다. 편광(DC) 및 해당 편광 곡선이 그림에 표시됩니다. 5(c). 그림을 보면 테스트 시간이 길어질수록 분극 전류는 점차 감소합니다. 테스트 시간이 5000초에 도달하면 분극 전류(I=3.1μA)는 테스트 시간에 따라 더 이상 변하지 않습니다. 연장됩니다. 식 (2, 3)을 통해 계산하면, SD-CS-NZSP는 1.23Ã10-7 Sâcm-1이고 나트륨 이온 마이그레이션 번호는 0.9998입니다. 이번 연구에서는 전기화학적 창도 측정했습니다. 순환전압전류법(CV)에 의한 SD-CS-NZSP의 측정[18]. 그림 5(d)에 표시된 것처럼 두 개의 산화 및 환원 피크는 약 0V에서 나타나며 이는 스트리핑을 나타냅니다. 및 나트륨의 침착이 각각 [20]. 이 외에는 다른 산화환원이 없다. 스캔된 전압 범위 내에서 피크가 관찰되었습니다. 이는 다음이 있음을 의미합니다. 전압에서 전해질의 분해로 인한 전류 변화 없음 0~6V 범위로 SD-CS-NZSP가 전기화학적 안정성이 우수함을 나타냅니다. 넓은 전기화학적 창(6V(vs. Na/Na+))은 나트륨 이온과 일치할 수 있습니다. 고체 전해질과 같은 고전압 양극 재료 니켈-망간 기반 양극재는 성능 향상에 도움이 됩니다. 나트륨 이온 배터리의 에너지 밀도
3 결론
고온고상법은 소결 온도에서 순수상 Na3Zr2Si2PO12 분말을 합성하는 데 사용됩니다. 과량의 Na와 P를 전구체에 도입하여 1150°C로 만듭니다. 분무건조 사용 분말을 구형으로 과립화하기 위해 폴리비닐알코올 바인더가 균일하게 Na3Zr2Si2PO12 입자 표면에 코팅된 입자 크기 분포는 정규분포에 가깝습니다. 준비된 밀도 Na3Zr2Si2PO12 세라믹은 97.5%에 도달합니다. 증가된 밀도는 효과적으로 감소시킬 수 있습니다. 입자 경계 저항 및 이온 전도도는 실온에서 6.96×10-4 S×cm-1에 도달하며 이는 세라믹 시트보다 높습니다. 기존의 소결 방법(4.94×10-4 S×cm-1)으로 제조되었습니다. 또한, 분무건조 방식으로 생산된 세라믹은 넓은 전기화학적 창을 가지고 있습니다. (6 V (vs. Na/Na+)) 고전압 음극 재료와 일치하여 배터리의 에너지 밀도를 높인다. 스프레이가 나오는 걸 볼 수 있어요 건조 방법은 Na3Zr2Si2PO12 세라믹 전해질을 제조하는 효과적인 방법입니다. 밀도가 높고 이온 전도성이 높으며 다른 유형에 적합합니다. 세라믹 고체 전해질
참고자료
[1] JIAN Z L, ZHAO L, PAN HL, et al. 나트륨 이온 배터리용 새로운 전극 재료로 탄소 코팅된 Na3V2(PO4)3. 전기화학통신, 2012,14(1):86-89.
[2] ZHAO L, ZHAO J M, HU Y S, et al. 고성능 양극 소재인 테레프탈산나트륨(Na2C8H4O4) 저가형 상온 나트륨 이온 배터리. 첨단에너지소재, 2012,2(8):962-965.
[3] RUAN YL, GUO F, LIU JJ, et al. Na3Zr2Si2PO12 세라믹 전해질 및 계면 최적화 고성능 전고체 나트륨 배터리. 세라믹스 인터내셔널, 2019,45(2):1770-1776.
[4] VETTER J, NOVAK P, WAGNER MR, et al. 리튬 이온 배터리의 노화 메커니즘. 전원 저널, 2005,147(1/2):269-281.
[5] KAMAYA N, HOMMA K, YAMAKAWA Y, et al. 에이 리튬 초이온 전도체. 자연재료, 2011,10(9):682-686.
[6] TARASCON J M, ARMAND M. 이슈 및 충전식 리튬 배터리가 직면한 과제. 자연, 2001,414(6861):359-367.
[7] KHOKHAR WA, ZHAO N, HUANG W L, et al. Na 및 Li 고체 전해질에서 금속 침투의 다양한 거동. ACS 응용 재료 및 인터페이스, 12(48):53781-53787.
[8] OUDENHOVEN J FM, BAGGETTO L, NOTTEN P H L. 전고체 리튬이온 마이크로배터리: 다양한 세 가지 배터리에 대한 검토 차원 개념. 첨단에너지재료, 2011,1(1):10-33.
[9] ZHAO C L, LIU LL, QI X G, et al. 전고체 나트륨 배터리. 첨단에너지재료, 2017,8(17):1703012.
[10] HAYASHI A, NOI K, SAKUDA A, et al. 상온 충전용 나트륨용 초이온성 유리-세라믹 전해질 배터리. 네이처 커뮤니케이션즈, 2012,3:856.
[11] LOU S F, ZHANG F, FU CK, et al. 전고체전지의 인터페이스 이슈와 과제: 리튬, 나트륨, 그리고 그 이상. 신소재, 2020,33(6):2000721.
[12] HUANG W L, ZHAO N, BI Z J 등. 할 수 있다 고체 가넷 전해질을 통한 Li 침투를 제거하는 솔루션을 찾았습니까? 머티리얼 투데이 나노, 2020,10:100075.
[13] JIAN Z L, HU Y S, JI XL, et al. 에너지 저장을 위한 NASICON 구조의 재료. 첨단재료, 2016,29(20):1601925.
[14] HOU WR, GUO X W, SHEN XY, et al. 전고체 나트륨 배터리의 고체 전해질 및 인터페이스: 진행 그리고 관점. 나노에너지, 2018,52:279-291.
[15] GOODENOUGH JB, 홍효P, KAFALAS J A. 골격 구조에서의 빠른 Na+ 이온 수송. 재료 연구 게시판, 1976,11(2):203-220.
[16] 홍효피. 결정구조와 Na1+xZr2SixP3-xO12 시스템의 결정 화학. 재료 연구 회보, 1976, 11(2):173-182.
[17] RAN LB, BAKTASH A, LI M, et al. 사우스 캐롤라이나, Ge 공동 도핑 NASICON은 고체 나트륨 이온 배터리 성능을 향상시킵니다. 에너지저장재료, 2021,40:282-291.
[18] YANG J, LIU G Z, AVDEEV M, 외. 매우 안정적인 전고체 나트륨 이차전지입니다. ACS 에너지 편지, 2020,5(9):2835-2841.
[19] LENG HY, HUANG JJ, NIE J Y, et al. Na3.256Mg0.128Zr1.872Si2PO12 고체의 냉소결 및 이온 전도도 전해질. 전원저널, 2018,391:170-179.
[20] HUANG C C, YANG GM, YU W H, et al. 갈륨 치환 Nasicon Na3Zr2Si2PO12 고체 전해질. 합금 저널 및 화합물, 2021,855:157501.
[21] ZHANG Z Z, ZHANG Q H, SHI J N, et al. 자가형성 나트륨전지용 복합전해질 매우 긴 사이클 수명. 첨단에너지재료, 2017,7(4):1601196.
[22] 아난타라물루 N, RAO K K, RAMBABU G, 외. Nasicon 유형의 재료에 대한 광범위한 검토. 재료 저널 과학, 2011,46(9):2821-2837.
[23] WANG X X, LIU Z H, TANG Y H, 외. Na3Zr2Si2PO12 고체의 저온 및 급속 마이크로파 소결 Na 이온 배터리용 전해질. 전원 저널, 2021,481:228924.
[24] GRADY Z M, TSUJI K, NDAYISHIMIYE A 등 알. 400 ℃ 미만의 고체 NASICON 나트륨 이온 전해질의 치밀화 융합 수산화물 용매를 이용한 냉간 소결. ACS 응용 에너지 재료, 2020,3(5):4356-4366.
[25] SHAO Y J, ZHONG GM, LU Y X, et al. 에이 Na 이온이 강화된 새로운 NASICON 기반 유리-세라믹 복합 전해질 전도도. 에너지저장재료, 2019,23:514-521.
[26] LENG HY, NIE J Y, LUO J. 결합 냉간 소결 및 Bi2O3 활성화 액상 소결을 통해 제조 감소된 온도에서 높은 전도성 Mg 도핑된 NASICON. 저널 물질공학, 2019,5(2):237-246.
[27] OH J A S, HE LC, PLEWA A, et al. Na+가 강화된 복합 NASICON(Na3Zr2Si2PO12) 고체 전해질 이온 전도성: 액상 소결의 효과. ACS 응용 재료 & 인터페이스, 2019,11(43):40125-40133.
[28] DA SILVA J GP, BRAM M, LAPTEV AM 등 알. 나트륨 기반 NASICON 전해질의 소결: 비교 연구 냉간, 현장 보조 및 기존 소결 방법 사이. 저널 유럽도자학회, 2019,39(8):2697-2702.
[29] WANG H, OKUBO K, INADA M, et al. 낮은 Na2O-Nb2O5-P2O5 유리로 촉진되는 온도 밀도가 높은 NASICON 기반 세라믹 첨가제 및 스파크 플라즈마 소결. 솔리드 스테이트 아이오닉스, 2018,322:54-60.
[30] HUO HY, GAO J, ZHAO N, et al. 에이 수상돌기가 없는 고체 리튬을 위한 유연한 전자 차단 계면 차폐물 금속 배터리. 네이처 커뮤니케이션즈, 2021,12(1):176.
[31] JIA M Y, ZHAO N, HUO HY, 외. 가넷 전해질에 대한 종합적인 조사 응용 지향적인 고체 리튬 배터리. 전기화학 에너지 리뷰, 2020,3(4):656-689.
[32] ZHAO N, KHOKHAR W, BI Z J, et al. 고체 가넷 배터리. Joule, 2019,3(5):1190-1199.
[33] VERTRUYEN B, ESHRAGHI N, PIFFET C 등 알. 리튬 및 나트륨 이온 배터리용 전극 재료의 분무 건조. 자료, 2018,11(7):1076.
[34] KOU Z Y, MIAO C, WANG Z Y, et al. 새로운 NASICON형 구조 Li1.3Al0.3Ti1.7SixP5(3-0.8x)O12 고체 리튬이온전지용 이온전도도가 향상된 전해질. 단단한 스테이트 아이오닉스, 2019,343:115090.
[35] SHEN L, YANG J, LIU G Z, et al. 높은 이온 전도성 및 수상돌기 저항성 NASICON 고체 전해질 전고체 나트륨 배터리. 머티리얼 투데이 에너지, 2021,20:100691.
[36] LI Y Q, WANG Z, LI CL, et al. 리튬가넷 고체의 치밀화 및 이온전도도 향상 흐르는 산소 소결에 의한 전해질. 전원 저널, 2014,248:642-646.