WANG Kunpeng ,1, LIU Zhaolin2, LIN Cunsheng2, WANG Zhiyu ,1,2
1. 중국 다롄 116024 대련이공대학교 화학공학부 정밀화학 국가 핵심 연구실
2. 신소재 개발 지점, Valiant Co., Ltd., Yantai 265503, China
초록
리튬 이온 배터리와 비교하여 Na 이온 배터리는 저렴한 비용, 우수한 저온 성능 및 안전성이라는 이점을 제공하여 비용 및 신뢰성에 민감한 응용 분야에서 큰 주목을 받고 있습니다. 고용량 및 저비용으로 PBA(프로이센 청색 유사 물질)는 Na 이온 배터리의 유망한 음극 소재로 자리잡고 있습니다. 그러나 구조 내에 결정질 물이 존재하면 배터리 성능이 빠르게 저하되어 애플리케이션을 제한하는 중요한 병목 현상이 발생합니다. 이 연구는 PBA 양극 재료에서 결정질 물을 효과적으로 제거하여 340사이클 후 용량 유지율을 73%에서 88%로 향상시키는 손쉬운 열처리 전략을 보고합니다. 현장 분석을 통해 PBA 음극의 쿨롱 효율의 초기 손실은 충전 및 방전 과정에서 삼각 형태에서 입방 상으로의 비가역적 변환의 결과라는 사실이 밝혀졌습니다. 이 문제는 음극에서 비가역적인 Na 손실을 보상하기 위해 Na2C2O4를 도입함으로써 해결될 수 있습니다. 이를 바탕으로 저수분 함량의 PBA 양극과 Na2C2O4 첨가제, 경질 탄소(HC) 양극을 폴리(에틸렌 글리콜) 디아크릴레이트(PEGDA) 내에 결합하여 고성능 준고체 Na 이온 배터리를 제작합니다. ) 기반의 준고체 전해질은 높은 이온 전도성과 전기화학적 안정성을 가지고 있습니다. 이 배터리는 20~500mA·g-1의 전류 밀도에서 58~105mAh·g-1 범위의 특정 용량을 나타내며 200사이클 이상 안정적인 사이클링을 유지할 수 있습니다. 본 연구는 PBA 양극재 내부의 결정수를 효율적으로 제거함으로써 PBA 양극재의 안정성과 용량이 크게 향상되었음을 강조합니다.키워드: Na 이온 배터리; 준고체전지; 프러시안 블루 음극; 현장분석
고성능 배터리 기술의 개발은 중국이 에너지 구조를 변화 및 업그레이드하고, 저탄소 청정 경제를 촉진하고, '탄소 중립 및 탄소 피크' 목표를 달성하기 위한 주요 전략적 요구입니다. 리튬이온 배터리는 가장 널리 사용되는 고효율 배터리 시스템 중 하나입니다. 그러나 지각에 존재하는 리튬의 양은 0.0065%에 불과하고, 중국의 리튬 자원 매장량은 세계 총량의 7%에 불과하며, 탄산리튬의 거의 70%가 수입된다. 향후 에너지 저장 및 전력 배터리 분야의 막대한 수요를 충족시키기는 어려울 것입니다. 지각에 존재하는 나트륨의 양은 리튬의 양보다 400배 이상 높습니다. 중국의 나트륨 매장량은 전 세계 나트륨 매장량의 약 22%를 차지한다. 원자재 비용 측면에서 나트륨이온 배터리는 리튬이온 배터리에 비해 원가를 30~40% 절감할 수 있다. 또한 나트륨 이온 배터리는 리튬 이온 배터리에 비해 저온 성능이 우수하고 작동 온도 범위가 넓으며 안전성이 높습니다. 이러한 고유한 장점으로 인해 비용에 민감하고 안전이 중요한 에너지 저장 응용 분야에서 주목을 받고 있습니다[1].
'이중 탄소' 목표에 힘입어 중국의 에너지 저장 및 전력 배터리 수요는 2020년 158.5GWh에 도달했으며, 세계 배터리 수요는 2025년에 TWh 시대에 진입할 것으로 예상됩니다. 배터리 기술의 발전으로 에너지 밀도는 배터리가 급속히 증가하고 배터리 안전에 대한 요구 사항이 점점 더 중요해지고 있습니다. 기존의 리튬/나트륨 이온 배터리는 누출되기 쉬운 액체 유기 전해질을 사용하므로 배터리의 신뢰성이 떨어집니다[2-3]. 열전 안정성이 높고, 기계적 강도가 높으며, 누출 위험이 없는 전고체 배터리를 사용하는 것은 신뢰성 문제를 해결하기 위한 가능한 방향이지만[4-5], 고체 전해질의 밀도가 높고, 이온 전도도가 낮은 등의 문제가 있습니다. , 전극의 "고체-고체" 경계면과의 접촉이 불량합니다[6]. 액체와 고체 사이의 준고체 전해질은 액체 전해질보다 안정성과 안전성이 우수하며, 이온 전도도, 유연성, 계면 호환성 측면에서 고체 전해질보다 우수하다[7~9]. 이러한 장점으로 인해 이를 기반으로 한 준고체 배터리는 첨단 배터리 기술 분야에서 가장 실현 가능한 초점 방향 중 하나가 되었습니다.
프러시안 블루 화합물(PBA)은 현재 나트륨 이온 배터리에 가장 많이 사용되는 양극 재료입니다. 개방형 골격 구조와 풍부한 나트륨 저장 장소는 높은 이론적 비용량(170mAh g-1)과 우수한 이온 수송 성능을 제공합니다[10-11]. 전고체 배터리에서 PBA는 양극재뿐만 아니라 고체 전해질로도 사용될 수 있다[12-13]. 그러나 PBA는 일반적으로 용액 침전에 의해 제조되는데, 이는 구조에 Fe(CN)64- 공극 결함과 다량의 결정수를 형성하여 Na+가 PBA 격자에 매립되는 것을 방해하고 나트륨 저장 용량을 제한합니다. 또한, PBA의 결정수는 배터리 반응 중에 점진적으로 전해질로 방출되어 급속한 배터리 성능 저하, 부반응, 고창 및 기타 문제를 야기합니다[11,14]. 이러한 문제로 인해 전고체 배터리에 PBA를 적용하는 것이 제한되고 대부분의 물에 민감한 무기 고체 전해질과 일치시키기가 어렵습니다. PBA에서 공극 결함 및 결정질 물의 형성은 열수 처리[15], 느린 공침[16], Fe2+ 산화 억제[17], 화학적 에칭[18] 및 원소 도핑[19- 20]. 그러나 관련 기술 공정이 복잡하고 정밀한 제어가 어려우며, 획득된 PBA 양극의 성능도 향상되어야 합니다. 위와 같은 문제점을 고려하여, 본 연구에서는 PBA의 결정수 함량을 줄이고 나트륨 저장 안정성을 향상시키기 위한 간단하고 효율적인 열처리 방법을 제안한다. 현장 중합 기술을 통해 높은 이온 전도도와 높은 전기화학적 안정성을 지닌 폴리에틸렌 글리콜 디아크릴레이트(PEGDA) 벤치마크 고체 전해질이 개발되었습니다. 이를 바탕으로 PEGDA 벤치마크 고체전해질에서 저수분 함량 PBA 양극과 경질탄소(HC) 양극을 매칭하고, 음극에 자기희생 나트륨 보상재로 Na2C2O4를 첨가해 고성능 준전해질을 구축했다. 고체 나트륨 이온 배터리. 현장 분석 기술을 통해 PBAs 양극과 HC 양극의 동적 나트륨 저장 메커니즘이 밝혀졌습니다.
1 실험방법
1.1 저수분 PBA 양극의 제조
116mmol 구연산나트륨과 24mmol FeSO4·7H2O를 탈산소화된 탈이온수 400mL에 용해시켰다. 116mmol 구연산나트륨 및 26mmol Na4Fe(CN)6를 탈산소화된 탈이온수 400mL에 용해시켰다. FeSO4가 포함된 용액을 Na4Fe(CN)6이 포함된 용액에 천천히 첨가하고 반응물을 일정한 온도에서 6시간 동안 교반하였다. 생성물을 에탄올과 탈산소화된 탈이온수로 원심분리하여 3회 세척한 후, 120℃에서 24시간 동안 진공 건조하여 결정수 함량이 높은 PBA(Hw-PBA)를 얻었다. 이를 아르곤으로 보호된 관상로에 넣고 270℃에서 2시간 동안 소성하여 수분 함량이 낮은 PBA(Lw-PBA)를 얻었으며 가열 속도는 0.5℃min-1입니다.
1.2 샘플 특성화
샘플 형태와 구조는 전계 방출 주사 전자 현미경을 사용하여 분석되었습니다. X선 광전자 분광계와 유도 결합 플라즈마 방출 분광계를 사용하여 샘플 화학 조성을 분석했습니다. 배터리는 분말 X선 회절계와 레이저 라만 분광기를 사용하여 현장에서 분석되었습니다. 샘플 결정의 수분 함량은 아르곤 분위기에서 10±min-1의 가열 속도로 열중량 분석기를 사용하여 분석되었습니다.
1.3 전지 조립 및 전기화학적 성능 시험
1.3.1 액체나트륨이온반전지 조립체
테스트를 위해 CR2016 버튼 셀을 조립했습니다. 프러시안 블루 양극재(Hw-PBAs 또는 Lw-PBAs), 케첸 블랙(KB) 및 폴리비닐리덴 플루오라이드(PVDF) 바인더를 8:1:1의 질량비로 균일하게 혼합하고, N-메틸피롤리돈(NMP)을 용매 및 분산제를 첨가하고, 생성된 슬러리를 탄소 코팅된 알루미늄 호일에 음극으로 균일하게 코팅하였으며, 활물질 함량은 3~4로 하였다. mg·cm-2. 금속 나트륨 시트는 상대 전극과 기준 전극으로 사용되었습니다. 전해질은 1.0 mol·L-1 NaClO4 및 5.0% 플루오로에틸렌 카보네이트(FEC)의 DMC/EC 용액(DMC: 디메틸 카보네이트, EC: 에틸렌 카보네이트, 부피비 1:1)이었습니다. 배터리는 아르곤이 충전된 글러브 박스(수분 함량 <10-7, 산소 함량 <10-7)에 조립되었습니다.
1.3.2 액체나트륨이온 전지 조립체
상기 방법으로 양극을 제조하였고, 음극은 HC를 사용하였으며, 양극과 음극의 N/P 비율은 1.1~1.2로 조절하였다. 상기 전해액을 사용하여 아르곤(수분 함량 <10-7, 산소 함량 <10-7)이 채워진 글러브 박스에 전지를 조립하였다.
1.3.3 준고체 전해질의 제조
PEGDA를 상기 액체전해질에 7:93의 질량비로 혼합하였다. 중합 개시제로 5.0% 아조비스이소부티로니트릴(AIBN)을 첨가하여 준고체 전해질 전구체 용액을 형성하였다. 이 용액을 60℃에서 10시간 동안 가열하여 준고체 전해질을 형성하였다.
1.3.4 준고체 나트륨이온 전지의 조립
양극재, Na2C2O4 나트륨 보충제, KB 도전제 및 PVDF 바인더를 6.4:1.6:1.0:1.0의 질량비로 균일하게 혼합하고, 용매 및 분산제로 NMP를 첨가하여 얻은 슬러리를 카본 위에 균일하게 코팅하였다. - 양극으로 알루미늄 호일을 코팅하고 활성 물질 함량이 3~4 mg·cm-2입니다. 음극으로는 HC를 사용하였으며, 양극과 음극의 N/P 비율은 1.1~1.2로 조절하였다. 준고체 전해질 전구체 용액을 전지에 첨가하고, 전지를 밀봉한 후 60℃에서 10시간 동안 가열하여 준고체 전지를 얻었다. 아르곤(수분 함량 <10-7, 산소 함량 <10-7)이 채워진 글러브 박스에 전지를 조립하였다.
1.3.5 배터리 성능 테스트
준고체 전해질의 이온 전도도는 전기화학적 워크스테이션을 사용하여 전기화학적 임피던스 분광법(EIS)으로 테스트되었습니다. 테스트 주파수 범위는 1Hz~1000kHz이고 섭동 전압 진폭은 5.0mV입니다. 준고체 전해질의 전기화학적 안정성 창은 5 mV·s-1의 스윕 속도로 선형 스윕 전압전류법(LSV)으로 테스트되었습니다. Land CT2001A 배터리 테스터를 이용하여 정전류 충방전 방식으로 재료 및 배터리 성능을 연구하였다. 반전지 전압 창은 2.0~3.8V(Na/Na+ 대비), 전체 셀 전압 창은 1.5~3.8V, 전류 밀도는 10~500mA·g-1이었습니다. 사이클 안정성 테스트에서는 먼저 전류밀도 50mA·g-1에서 전지를 5회 사이클한 후, 다양한 전류밀도에서 사이클 안정성 테스트를 수행하였다.
2 결과 및 논의
2.1 형태 및 조성분석
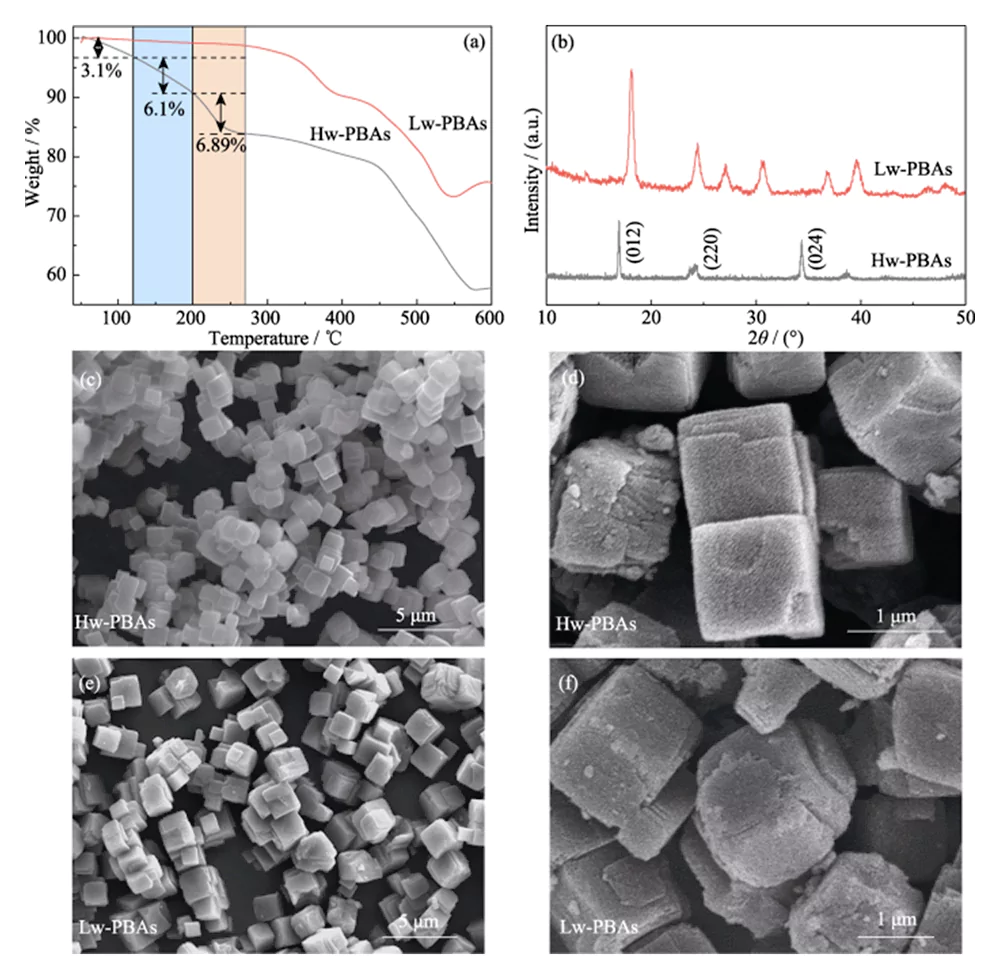
그림 1(a)의 Hw-PBA의 TGA 곡선은 급격한 체중 감소의 두 영역, 즉 1) 실내 온도 ~ 270°C, 2) 440 ~ 580°C를 보여줍니다. 전자 영역에서는 실온에서 120°C까지의 중량 감소(질량 분율 3.1%)는 흡착된 물의 제거로 인해 발생합니다. 120°C에서 200°C까지의 중량 감소(질량 분율 6.10%)는 PBA 프레임워크 구조에서 틈새 수분 제거로 인해 발생합니다. 200°C에서 270°C까지의 중량 손실(질량 분율 6.89%)은 PBA에서 결정수 제거에 해당합니다. 따라서 Hw-PBA에서 수분을 제거하기 위해 270°C 열처리가 선택되었습니다. 이 온도에서 열처리한 후, 얻은 Lw-PBA는 실온 ~270℃에서 중량의 약 1.18%만 손실되었으며, 이는 Hw-PBA보다 92.67% 낮았습니다. 200~270℃에서 약 0.74%의 무게감소를 보였는데, 이는 Hw-PBA에 비해 89.26% 낮은 수치이다. 위의 결과는 열처리가 PBA에 존재하는 다양한 종류의 수분을 효과적으로 제거할 수 있음을 보여주며, 획득된 저수분 PBA는 열안정성이 우수함을 보여준다.
그림. 1 TGA, PBA 음극의 형태 및 구조 분석
(a) TGA 곡선 및 (b) Hw-PBA 및 Lw-PBA의 XRD 패턴; (c-f) (c, d) Hw-PBA 및 (e, f) Lw-PBA의 SEM 이미지
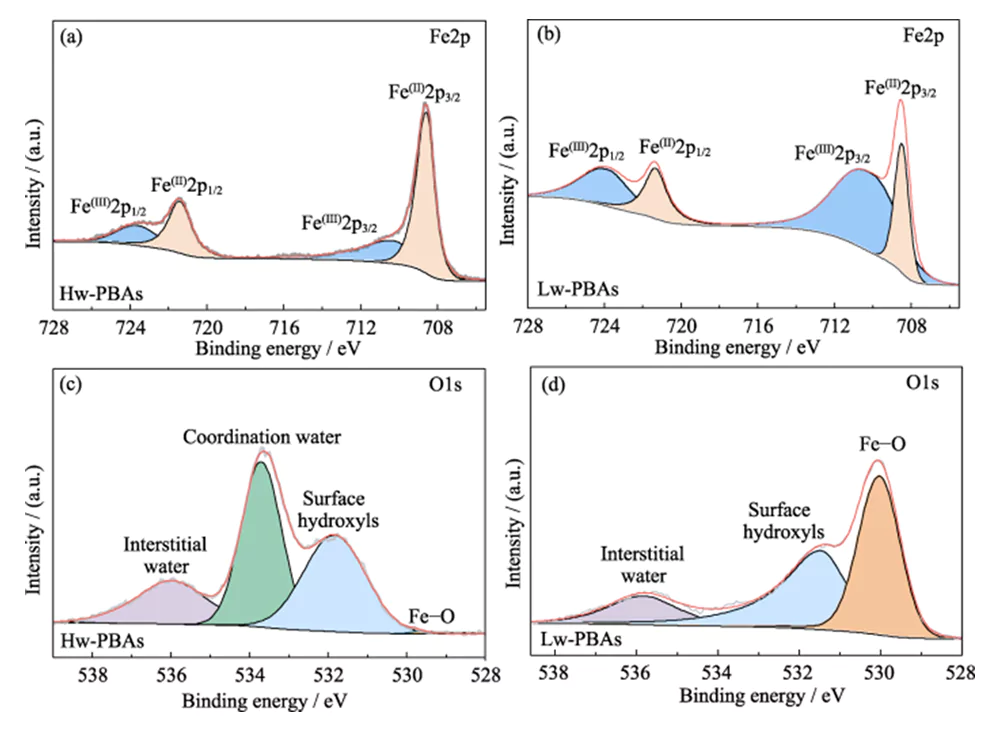
그림 1(b)는 Hw-PBA와 Lw-PBA의 XRD 스펙트럼을 보여줍니다. 2θ=17.0°, 24.0° 및 34.4°에서 Hw-PBA의 회절 피크는 각각 (012), (220) 및 (024) 결정 평면에 해당합니다. 열처리 후에는 (024) 결정면에 해당하는 회절 피크가 사라져 결정수가 성공적으로 제거되었음을 나타내며, (012) 및 (220) 결정면에 해당하는 회절 피크 위치가 더 높은 각도로 이동하여 결정수가 제거된 후 단위 셀 부피는 감소합니다. 또한, 2θ=27.1°, 30.7°, 36.9°에서 새로운 회절 피크가 나타나 열처리 후 삼각 결정 구조가 형성되었음을 나타냅니다. SEM 분석(그림 1(c~e))은 Hw-PBA와 Lw-PBA가 평균 크기가 2~3μm인 유사한 입방체 형태를 가짐을 보여줍니다. 열처리 후 얻은 Lw-PBAs 입자의 표면은 약간 거칠지만(그림 1(f)), 낮은 열처리 온도로 인해 뚜렷한 용융 및 응집이 발생하지 않았습니다. Lw-PBA의 조성은 ICP-OES로 금속원소 함량을 분석하고 TGA로 수분함량을 측정하여 Na1.91Fe-[Fe(CN)6]·3.2H2O로 추정되었다.Hw-PBA와 Lw-PBA의 화학적 조성과 구조를 더 자세히 조사하기 위해 XPS 분석을 수행했습니다. Hw-PBA의 고해상도 Fe2p XPS 스펙트럼에서 결합 에너지 708.6 및 721.4eV의 두 가지 특징적인 피크는 각각 Fe(II) 및 Fe(III)에 해당합니다(그림 2(a)). Fe(II)와 Fe(III)도 Lw-PBA에 존재하지만 Fe(III)의 비율이 크게 증가합니다(그림 2(b)). 이는 열처리 과정에서 PBAs 구조에서 [NaH2O]+가 제거되고, Lw-PBAs의 Fe(II)가 부분적으로 산화되어 원자가 평형을 유지하기 때문이다. Hw-PBA의 고해상도 O1s XPS 스펙트럼에서 536.0, 533.7, 531.9 및 529.7eV의 결합 에너지의 특징적인 피크는 각각 PBA 격자의 간극수, 배위수, 표면 수산기 및 산소종에 해당합니다(그림 2(c)). 열처리 후에는 배위수에 해당하는 특성 피크가 사라지며, 이는 이 공정이 Lw-PBA에서 배위수를 효과적으로 제거할 수 있음을 나타냅니다(그림 2(d)). 이 과정에서 PBA 표면의 Fe는 수산기와 반응하여 산화철을 형성하고 결합에너지 530.0eV에서 Fe-O 특성 피크가 크게 향상됩니다.
그림. 2 PBA 음극의 화학적 조성
(a, b) (a) Hw-PBA 및 (b) Lw-PBA의 Fe2p XPS 스펙트럼; (c, d) (c) Hw-PBA 및 (d) Lw-PBA의 O1s XPS 스펙트럼
2.2 전기화학적 성능
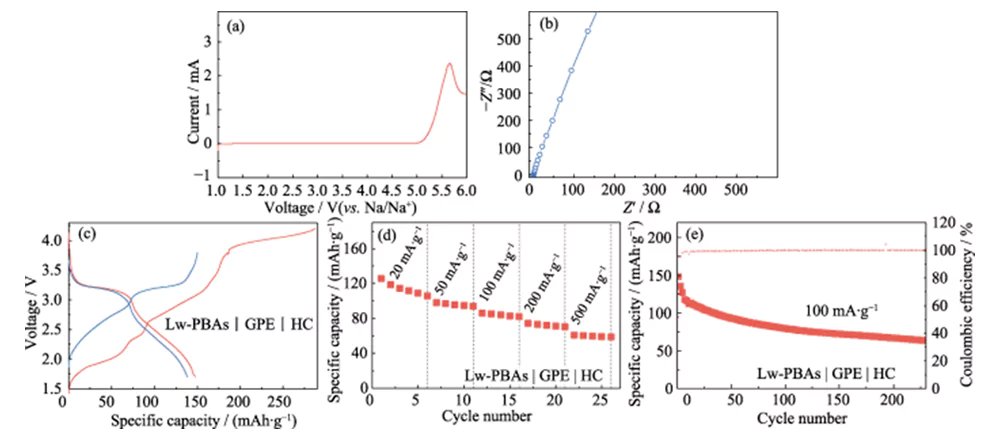
그림 3(a)는 Hw-PBA 및 Lw-PBA를 양극으로 사용하는 나트륨 이온 반쪽 전지의 전류 밀도 100mA·g-1, 전압 창 2.0~의 정전류 충방전 사이클 곡선을 보여줍니다. 3.8V(Na/Na+ 대비). 340회 충방전 주기 이후에도 Lw-PBA 양극은 91mAh·g-1의 높은 비용량을 유지할 수 있으며, 용량 유지율은 88%, 평균 단일 충방전 용량 손실률은 0.035에 불과합니다. %로 우수한 사이클 안정성을 보여줍니다. 동일한 충방전 조건에서 결정수를 제거하지 않은 Hw-PBAs 양극의 용량 유지율은 73%에 불과하여 PBAs 양극의 사이클 안정성을 향상시키는 데 결정수 제거의 중요한 역할을 보여줍니다. 그림 3(b)는 전류 밀도 100mA·g-1에서 Lw-PBAs 음극의 정전류 충전-방전 곡선을 보여 주며, 일반적인 이중 전압 플랫폼 기능을 보여줍니다. (1) 약 3.2V의 전압 플랫폼은 해당 저스핀 Fe2+/Fe3+(C와 배위)의 산화환원 과정; (2) 약 2.9V의 전압 플랫폼은 고스핀 Fe2+/Fe3+(N과 배위)의 산화환원 과정에 해당합니다. 약 3.2V에서 전압 플랫폼이 나타나는 것은 결정수 제거가 PBA에서 저스핀 Fe2+/Fe3+의 산화환원 반응을 강화하는 데 유익하며 이는 나트륨 저장 용량을 향상시키는 데 도움이 된다는 것을 나타냅니다. 후속 사이클 공정에서 Lw-PBAs 음극의 충방전 곡선은 기본적으로 일관되게 유지되어 우수한 구조적 안정성을 보여주었습니다. 10, 50, 100, 200 및 500mA·g-1의 전류 밀도에서 Lw-PBAs 음극은 126, 112, 110, 108 및 107mAh·g-1의 높은 가역 비용량을 유지할 수 있습니다(그림 3). (기음)). 특히, Lw-PBAs 양극은 500mA·g-1의 높은 전류밀도에서 우수한 용량 유지율을 가지며, 비용량은 Hw-PBAs에 비해 약 13.4% 높다. 전류밀도가 다시 10mA·g-1로 떨어지면 Lw-PBAs 양극 비용량은 초기 비용량에 가까운 125mAh·g-1로 회복돼 우수한 구조를 유지할 수 있음을 알 수 있다. 나트륨 급속 저장 시 안정성.
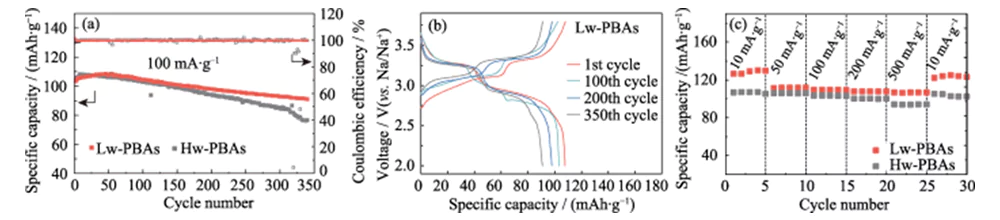
그림. 3 Na 이온 반전지에서 PBA 양극의 전기화학적 성능
(a) 전류 밀도 100mA·g-1에서 Lw-PBAs 및 Hw-PBAs 음극의 사이클링 성능; (b) 100mA·g-1에서 Lw-PBA 음극의 충전-방전 곡선; (c) 10mA·g-1에서 500mA·g-1까지 다양한 전류 밀도에서 Lw-PBA 및 Hw-PBA 음극의 속도 성능; 모든 반전지 테스트에 대한 전압 창은 2.0-3.8V(Na/Na+ 대비)입니다. 다채로운 그림은 웹사이트에서 확인하실 수 있습니다
2.3 나트륨 저장 메커니즘의 현장분석
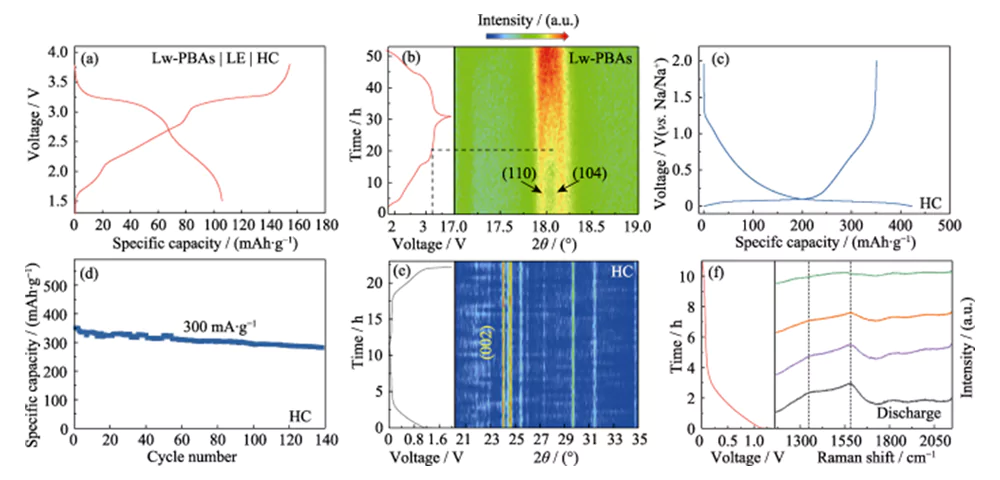
Lw-PBAs 양극을 HC 음극과 매칭하고, 1.0 mol·L-1 NaClO4와 5.0% FEC를 함유한 DMC/EC 용액을 액체 전해질(LE)로 사용하여 전체 배터리(Lw)를 조립했습니다. -PBA|LE|HC, 그림 4(a)). 충전 및 방전 반응 중 전체 배터리의 양극 및 음극 재료의 동적 구조 변화를 현장 분석 기술을 사용하여 연구했습니다. Lw-PBAs 양극의 in-situ XRD 분석 결과, 충전 전압을 3.2V로 증가시킨 후 (110)과 (104)에 해당하는 회절 피크가 점차 합쳐져 넓은 피크를 형성하는 것으로 나타났습니다(그림 4(b)). ). 이러한 현상은 Lw-PBAs 양극에서 Na+가 빠져나와 결정 구조가 삼각 구조에서 입방 구조로 변화하는 과정에 해당합니다. 방전 과정에서 이 넓은 피크가 (110) 및 (104) 회절 피크로 다시 분할되지 않았으며 이는 상 변화 과정이 되돌릴 수 없어 첫 번째 쿨롱 효율 손실이 발생했음을 나타냅니다. 또한, HC 음극의 1차 충방전 과정에서 표면에 형성된 SEI(Solid Electrolyte Interphase)막이 비가역적인 리튬 손실(18%)을 초래하는데, 이는 1차 쿨롱 효율이 나타나는 이유 중 하나이기도 하다. 배터리 전체의 손실(그림 4 (c, d)).
그림. 4 Lw-PBA 양극 및 HC 양극의 Na 저장 메커니즘 현장 분석
(a) Lw-PBAs|LE|HC 풀셀의 충방전 곡선; (b) 전체 셀 작동 중 Lw-PBA 음극의 현장 XRD 패턴; (c) 첫 번째 사이클에 대한 충전-방전 곡선 및 (d) 전류 밀도 300mA·g-1에서 HC 양극의 사이클링 안정성; (e) 전체 셀 작동 중 HC 양극의 현장 XRD 패턴 및 (f) 현장 라만 스펙트럼; 다채로운 그림은 웹사이트에서 확인하실 수 있습니다
HC 양극의 in-situ XRD 스펙트럼에서는 충방전 과정에서 명백한 (002) 피크 이동이 관찰되지 않았는데, 이는 Na+가 흑연화된 구조층에 삽입되지 않았으며 나트륨 금속으로부터 회절 피크가 관찰되지 않았음을 나타냅니다. 그림 4(e)). 따라서 HC 양극의 나트륨 저장 용량은 Na+ 삽입이나 금속성 나트륨 침전보다는 HC의 풍부한 결함 부위와 기공에서 Na+의 흡착 및 충전으로 인한 것일 수 있습니다. HC의 나트륨 저장 반응 메커니즘을 더 연구하기 위해 충전 및 방전 과정 동안 HC 음극에 대해 현장 라만 분석을 수행했습니다(그림 4(f)). HC 음극은 1350cm-1과 1594cm-1에서 뚜렷한 라만 특성 피크를 나타냅니다. 파수 1350cm-1의 특성 피크는 방향족 탄소 구성 신장 진동(G 모드)에 해당하고, 파수 1594cm-1의 특성 피크는 무질서한 결함 탄소 구조(D 모드)에 해당합니다. D 모드와 G 모드의 강도비(ID/IG)를 이용하여 탄소재료의 결함 및 흐트러짐 정도를 측정할 수 있습니다. 방전 과정에서 HC 양극의 ID/IG는 Na+의 지속적인 삽입에 따라 감소했는데, 이는 결함 부위에서 Na+의 중요한 흡착 거동이 HC 양극의 나트륨 저장 용량의 주요 원인임을 나타냅니다.
2.4 준고체 풀셀의 구성 및 성능
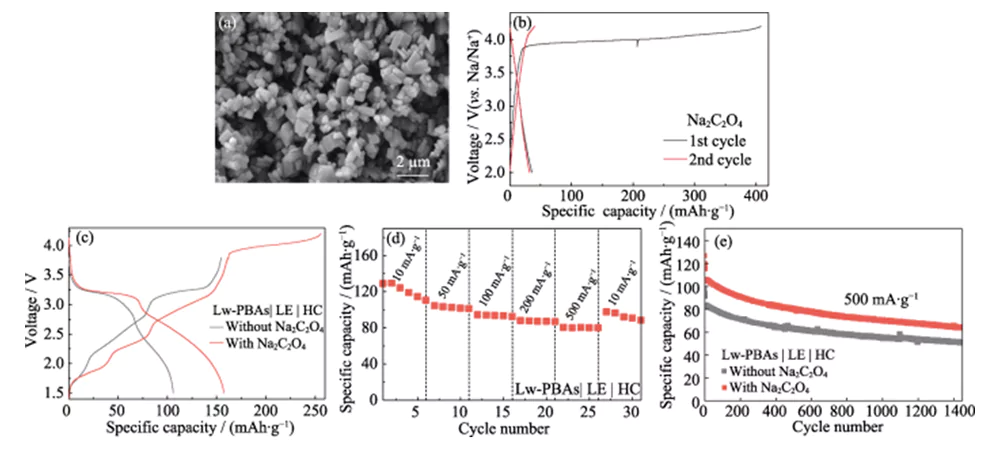
Lw-PBAs 양극과 HC 음극을 사용하여 구성된 나트륨 이온 완전 셀의 첫 번째 쿨롱 효율은 67.3%에 불과합니다(그림 4(a)). 이 문제를 해결하기 위해 환경 친화적이고 독성이 낮으며 공기에 안정한 Na2C2O4를 Lw-PBAs 양극의 자기 희생 나트륨 보상제로 사용하여 전체 셀의 첫 번째 쿨롱 효율을 향상시킵니다. 상업용 Na2C2O4의 입자 크기는 수백 마이크론 이상이고 전기화학적 활성이 좋지 않습니다. 따라서 이를 재결정하여 수 마이크론 크기의 Na2C2O4를 얻는다(그림 5(a)). 마이크론 크기의 Na2C2O4는 2.0~4.2V의 전압 창 내에서 첫 번째 충전 과정 동안 407mAh·g·1의 높은 비용량을 방출하여 양극의 첫 번째 비가역 용량 손실을 효과적으로 보상할 수 있습니다(그림 5(b) )). Na2C2O4(질량 분율 20%)를 첨가한 Lw-PBAs|LE|HC 풀 셀의 초기 방전 비용량은 158mAh·g-1에 도달할 수 있으며, 이는 첨가하지 않은 풀 셀보다 92.7% 더 높습니다. Na2C2O4(그림 5(c)). Na2C2O4가 첨가된 Lw-PBAs|LE|HC 전체 셀은 10, 50, 100, 200 및 500mA의 전류 밀도에서 110, 101, 92, 87 및 80mAh·g-1의 가역 비용량을 유지할 수 있습니다. ·g-1(그림 5(d)). 500mA·g-1의 높은 전류 밀도에서 1400회의 안정적인 사이클 이후 Na2C2O4를 첨가한 Lw-PBAs|LE|HC 전체 셀은 25.4%인 64mAh·g-1의 특정 용량을 유지할 수 있습니다. Na2C2O4를 첨가하지 않은 전체 셀보다 높습니다(그림 5(e)).
그림. 5 Lw-PBAs 음극의 전기화학적 성능에 대한 Na2C2O4의 영향
(a) SEM 이미지 및 (b) 전류 밀도 180mA·g-1에서 마이크로미터 크기의 Na2C2O4 충방전 곡선; (c) 전류 밀도 100mA·g-1에서 Na2C2O4를 채택하거나 채택하지 않은 Lw-PBAs|LE|HC 전체 셀의 충전-방전 곡선; (d) 10~500mA·g-1의 다양한 전류 밀도에서 Na2C2O4를 사용한 Lw-PBAs|LE|HC 전체 셀의 속도 성능; (e) 500mA·g-1의 큰 전류 밀도에서 Na2C2O4를 사용하거나 사용하지 않고 Lw-PBAs|LE|HC 전체 셀의 사이클링 안정성; 모든 전체 셀 테스트의 전압 창은 1.5~3.8V입니다. 다채로운 그림은 웹사이트에서 확인하실 수 있습니다
이를 바탕으로 PEGDA를 1.0 mol·L-1 NaClO4 및 DMC/EC 전해질과 질량분율 5.0% FEC로 혼합하고, AIBN을 열중합 개시제로 사용하여 고성능 준고체 전해질(GPE) 개발 ). LE에 비해 GPE는 누출 가능성이 적고 변동성이 낮다는 장점이 있습니다. 이는 4.9V(Na/Na+ 대비)의 고전압에서 안정적으로 유지될 수 있으며 전기화학적 안정성 범위가 넓습니다(그림 6(a)). 고체 전해질과 비교하여 GPE는 더 높은 이온 전도도와 인터페이스 호환성을 가지며 실온 이온 전도도는 3.51 mS·cm-1입니다(그림 6(b)). 또한 저수분 함량의 Lw-PBAs 양극과 HC 음극을 매칭하여 준고체 나트륨이온 전지(Lw-PBAs|GPE|HC)를 구성하였다. 100mA·g-1의 전류 밀도에서 Lw-PBAs|GPE|HC 준고체 배터리의 첫 번째 방전 비용량은 147.8mAh·g-1에 도달했습니다(그림 6(c)). 20, 50, 100, 200 및 500 mA·g-1의 전류 밀도에서 비용량은 105, 94, 82, 70 및 58 mAh·g-1로 유지될 수 있습니다(그림 6(d)). 전류밀도 100mA·g-1에서는 200회 이상 안정적으로 순환할 수 있으며 쿨롱 효율은 100%에 가깝다(그림 6(e)).
그림. 6 Lw-PBA 음극과 PEGDA 기반 GPE를 기반으로 한 준고체 완전전지의 전기화학적 성능
(a) 5mV·s-1의 스캔 속도에서의 LSV 곡선; (b) EIS 스펙트럼; (c) 전류 밀도 100mA·g-1에서의 충방전 곡선; (d) 전류 밀도 20-500mA·g-1에서의 속도 성능; (e) 100mA·g-1에서의 사이클링 성능; 모든 전체 셀 테스트에 대한 전압 창은 1.5-3.8V입니다.
3 결론
본 연구에서는 간단하고 효율적인 열처리 방법을 통해 저수분 함량의 PBA 양극재를 제조하였다. 결정수를 제거하면 340사이클 후 PBA 양극의 용량 유지율이 73%에서 88%로 증가했을 뿐만 아니라 PBA에서 저스핀 Fe2+/Fe3+의 산화환원 반응을 강화하는 데 도움이 되는 것으로 나타났습니다. 나트륨 저장 용량. PBA 음극과 HC 양극의 동적 나트륨 저장 메커니즘은 현장 라만 및 현장 XRD 기술에 의해 밝혀졌습니다. 분석 결과, PBA 양극에서 Na+가 빠져나가는 과정에서 결정 구조가 3차원 입방체에서 비가역적으로 변화되어 첫 번째 음극이 손실되는 것으로 나타났습니다.쿨롱 효율, 결함 부위에서의 Na+ 흡착은 HC 양극의 나트륨 저장 용량의 주요 원천이었습니다. Na2C2O4 나트륨 보상제(질량 분율 20%)를 음극에 첨가한 후 PBAs 음극의 첫 번째 방전 용량은 92.7% 증가했습니다. AIBN에 의해 시작된 PEGDA의 열중합을 기반으로 실온 이온 전도도가 3.51mS·cm-1이고 전기화학적 안정성 창이 4.9V(Na/Na+ 대비)로 넓어진 고성능 준고체 전해질이 개발되었습니다. 이를 기반으로 Na2C2O4 나트륨 보상제가 첨가된 저수분 PBA 양극, HC 양극 및 PEGDA 벤치마크 고체 전해질을 통합하여 200회 이상 안정적으로 순환할 수 있는 준고체 나트륨 이온 배터리를 구성했습니다. 100mA·g-1의 전류 밀도. 연구 결과에 따르면 PBA 양극의 사이클 안정성을 향상시키고 고성능 준고체 나트륨 이온 배터리를 구현하려면 결정수의 효율적인 제거가 필요한 수단인 것으로 나타났습니다.
[1] WANG W L, GANG Y, PENG J 등. 나트륨이온전지용 프러시안블루 양극의 수분 제거 효과. 고급 기능 Mater., 2022, 32(25): 2111727.
[2] MENG X Y, LIU Y Z, WANG Z Y, et al. 겔 전해질 내 Li2S의 안정적인 산화환원 화학을 통해 구현되는 높은 에너지와 우수한 안전성을 갖춘 준고체 이차 전지입니다. 에너지 환경. 과학, 2021, 14(4): 2278.
[3] CHE HY, CHEN SL, XIE Y Y, et al. 상온 나트륨이온전지의 전해질 설계 전략 및 연구 진행 상황. 에너지 환경. 과학, 2017, 10(5): 1075.
[4] LI W K, ZHAO N, BI Z J, et al. Na3Zr2Si2PO12 Na이온 전지용 세라믹 전해질: 분무건조법을 이용한 제조 및 그 특성. J.Inorg. Mater., 2022, 37(2) : 189.
[5] LID, LEI C, LAI H, et al. 모든 고체 리튬 이온 배터리에 대한 음극과 가넷 고체 전해질 사이의 인터페이스에 대한 최근 발전. J.Inorg. Mater., 2019, 34(7): 694.
[6] KIM KJ, BALAISH M, WADAGUCHI M, 외. 고체 리튬 금속 배터리: 산화물 및 황화물 고체 전해질과 그 인터페이스의 과제와 지평. 고급 에너지재료, 2021, 11(1): 2002689.
[7] GAO H, GUO B, SONG J, et al. 나트륨 이온 배터리용 복합 젤-폴리머/유리섬유 전해질입니다. 고급 에너지재료, 2015, 5(9): 1402235.
[8] LIU Y Z, MENG XY, SHI Y, et al. Li 보상 결합 인터페이스 엔지니어링을 통해 구현된 긴 수명의 준고체 양극 없는 배터리. 고급 Mater., 2023, 35(42): e2305386.
[9] DU G Y, TAO ML, LI J, et al. 폴리머 전해질과 프러시안 블루 음극을 기반으로 하는 낮은 작동 온도, 높은 속도 및 내구성의 고체 나트륨 이온 배터리입니다. 고급 에너지재료, 2020, 10(5): 1903351.
[10] PENG J, ZHANG W, LIU Q N, et al. 나트륨 이온 배터리에 대한 프러시안 블루 유사체: 과거, 현재, 미래. 고급 Mater., 2022, 34(15): 2108384.
[11] LU Y H, WANG L, CHENG J G, et al. 프러시안 블루(Prussian blue): 나트륨 배터리용 전극 소재의 새로운 뼈대. 화학. Commun., 2012, 48(52): 6544.
[12] SäNGELAND C, MOGENSEN R, BRANDELL D, 외. 폴리카보네이트 기반 고분자 전해질을 이용한 나트륨금속 전고체전지의 안정적인 사이클링. ACS 응용 프로그램. 폴리. Mater., 2019, 1(4): 825.
[13] KIM T, AHN SH, SONG Y Y, et al. 모든 전고체 배터리용 프러시안 블루형 나트륨 이온 전도성 고체 전해질. 앤쥬. 화학. 국제 Ed., 2023, 62(42): e202309852.
[14] SONG J, WANG L, LU Y H, et al. 나트륨 이온 배터리의 우수한 음극을 위한 헥사시아노메탈레이트의 침입형 H2O 제거. J.Am. 화학. Soc., 2015, 137(7): 2658.
LIU Y, FAN S, GAO Y, et al. 나트륨 이온 배터리용 철 기반 프러시안 블루 유사체의 등구조 합성. 소, 2023, 19(43): e2302687.
[16] WANG W, GANG Y, HU Z, et al. 나트륨 이온 배터리를 위한 나트륨이 풍부한 마름모꼴 프러시안 블루의 가역적 구조 진화. Nat. Commun., 2020, 11: 980.
[17] YOU Y, YU X Q, YIN Y X, et al. Na 함량이 높은 헥사시아노철산나트륨은 Na 이온 배터리용 Na가 풍부한 양극재로 사용됩니다. Nano Res., 2014, 8(1): 117.
[18] REN W H, QIN M S, ZHU Z X, 외. 표면 에칭을 통한 프러시안 블루 유사체의 나트륨 저장 장소 활성화. Nano Lett., 2017, 17(8): 4713.
[19] ZHANG H, GAO Y, PENG J, et al. 450Wh·kg·1 알칼리 이온 배터리에 대해 최적화된 결정 평면 방향과 낮은 결정 결함을 갖춘 프러시안 블루 유사체입니다. 앤쥬. 화학. 국제 Ed., 2023, 62(27): e202303953.
[230][20] ZHANG ZH, AVDEEV M, CHEN HC, et al. 안정적인 비수성 리튬 이온 배터리용 양극 활성 물질인 리튬화 프러시안 블루 유사체. Nat. Commun., 2022, 13: 7790.
JIANG M, HOU Z, MA H, et al. 전자 밀도를 고에너지 나트륨 저장 방향으로 재분배하여 저스핀 Fe 사이트의 비활성화 문제를 해결합니다. Nano Lett., 2023, 23(22): 10423.
[22] TANG Z, ZHANG R, WANG HY, et al. 첨단 나트륨이온전지용 폐목재 유래 하드카본의 폐쇄 기공 형성을 규명합니다. Nat. Commun., 2023, 14: 6024.
NIU Y B, GUO Y J, YIN Y X, et al. 나트륨 이온 배터리를 위한 고효율 양극 나트륨 보상. 고급 Mater., 2020, 32(33): e2001419.